Открытия в области строения атома стали важным шагом в развитии физики. Огромное значение имела модель Резерфорда. Атом как система и частицы, его составляющие, был изучен более точно и подробно. Это привело к успешному становлению такой науки, как ядерная физика.
Античные представления о строении вещества
Предположение о том, что окружающие тела состоят из мельчайших частиц, были высказаны еще в античные времена. Мыслители того времени представляли атом в виде мельчайшей и неделимой частицы любого вещества. Они утверждали, что нет во Вселенной ничего меньшего по размеру, чем атом. Таких взглядов придерживались великие древнегреческие ученые и философы – Демокрит, Лукреций, Эпикур. Гипотезы этих мыслителей сегодня объединены под названием «античный атомизм».
Средневековые представления
Времена античности прошли, и в средние века также были ученые, которые высказывали различные предположения о строении веществ. Однако преобладание религиозных философских взглядов и власть церкви в тот период истории на корню пресекали любые попытки и стремления человеческого разума к материалистическим научным выводам и открытиям. Как известно, средневековая инквизиция весьма недружелюбно вела себя с представителями научного мира того времени. Остается сказать, что у тогдашних светлых умов было пришедшее из античности представление о неделимости атома.
Исследования 18-19 веков
18 столетие было отмечено серьезными открытиями в области элементарного строения вещества. Во многом благодаря стараниям таких ученых, как Антуан Лавуазье, Михаил Ломоносов и Джон Дальтон. Независимо друг от друга они сумели доказать, что атомы действительно существуют. Но вопрос об их внутреннем строении оставался открытым. Конец 18 века был отмечен таким знаменательным событием в научном мире, как открытие Д. И. Менделеевым периодической системы химических элементов. Это стало по-настоящему мощным прорывом того времени и приоткрыло завесу над пониманием того, что все атомы имеют единую природу, что они родственны друг другу. В дальнейшем, в 19 веке, еще одним важным шагом на пути к разгадке строения атома стало доказательство того, что в составе любого из них присутствует электрон. Работа ученых этого периода подготовила благодатную почву для открытий 20-го века.
Эксперименты Томсона
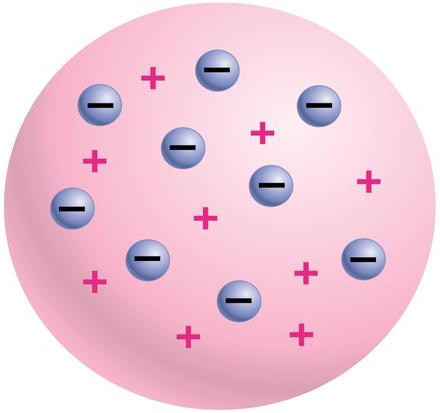
Английский физик Джон Томсон в 1897 году доказал, что в состав атомов входят электроны с отрицательным зарядом. На этом этапе ложные представления о том, что атом – предел делимости любого вещества, были окончательно разрушены. Как же Томсон сумел доказать существование электронов? Ученый в своих опытах помещал в сильно разреженные газы электроды и пропускал электрический ток. В результате возникали катодные лучи. Томсон тщательно изучил их особенности и обнаружил, что они являются потоком заряженных частиц, которые движутся с огромной скоростью. Ученый сумел высчитать массу этих частиц и их заряд. Он также выяснил, что их нельзя преобразовать в нейтральные частицы, поскольку электрический заряд – это основа их природы. Так были открыты электроны. Томсон является и создателем первой в мире модели строения атома. Согласно ей, атом – это сгусток положительно заряженной материи, в которой равномерно распределены отрицательно заряженные электроны. Такое строение объясняет общую нейтральность атомов, так как противоположные заряды уравновешивают друг друга. Опыты Джона Томсона стали неоценимо важными для дальнейшего изучения строения атома. Однако многие вопросы оставались без ответа.
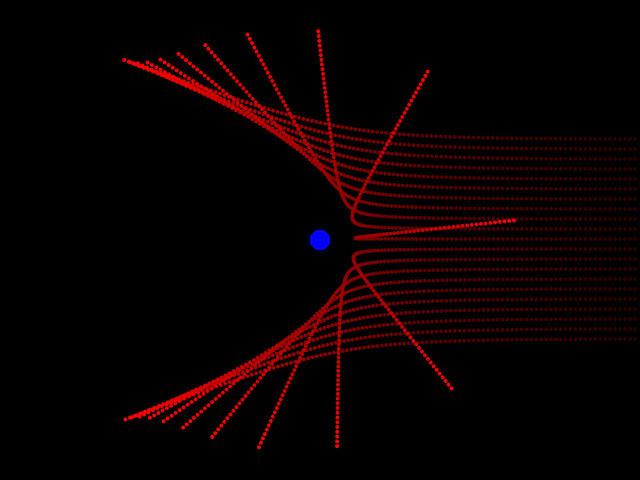
Исследования Резерфорда
Томсон открыл существование электронов, но он не сумел найти в атоме положительно заряженных частиц. Эрнест Резерфорд исправил это недоразумение в 1911 году. Во время экспериментов, изучая активность альфа-частиц в газах, он обнаружил, что в атоме присутствуют частицы, положительно заряженные. Резерфорд увидел, что при прохождении лучей сквозь газ или через тонкую металлическую пластину происходит резкое отклонение незначительного количества частиц от траектории движения. Их буквально отбрасывало назад. Ученый догадался, что такое поведение объясняется столкновением с положительно заряженными частицами. Такие эксперименты позволили физику создать модель строения атома Резерфорда.

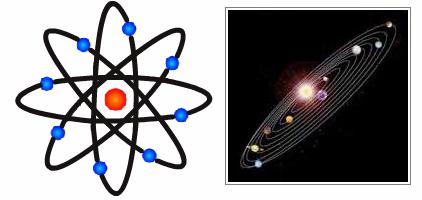
Планетарная модель
Теперь представления ученого несколько отличались от предположений, высказанных Джоном Томсоном. Разными стали и их модели атомов. Опыт Резерфорда позволил ему создать совершенно новую теорию в этой области. Открытия ученого имели решающее значение для дальнейшего развития физики. Модель Резерфорда описывает атом как ядро, расположенное в центре, и движущиеся вокруг него электроны. Ядро обладает положительным зарядом, а электроны – отрицательным. Модель атома по Резерфорду предполагала вращение электронов вокруг ядра по определенным траекториям – орбитам. Открытие ученого помогло объяснить причину отклонения альфа-частиц и стало толчком к развитию ядерной теории атома. В модели атома Резерфорда прослеживается аналогия с движением планет Солнечной системы вокруг Солнца. Это очень точное и яркое сравнение. Поэтому модель Резерфорда, атом в которой движется вокруг ядра по орбите, была названа планетарной.
Работы Нильса Бора
Двумя годами позже датский физик Нильс Бор попытался объединить представления о строении атома с квантовыми свойствами светового потока. Ядерная модель атома Резерфорда была положена ученым в основу его новой теории. По предположению Бора, атомы вращаются вокруг ядра по круговым орбитам. Такая траектория движения приводит к ускорению электронов. Кроме того, кулоновское взаимодействие этих частиц с центром атома сопровождается созданием и расходованием энергии для поддержания пространственного электромагнитного поля, возникающего из-за движения электронов. При таких условиях отрицательно заряженные частицы должны когда-нибудь упасть на ядро. Но этого не происходит, что указывает на большую устойчивость атомов как систем. Нильс бор понял, что законы классической термодинамики, описанные уравнениями Максвелла, не работают во внутриатомных условиях. Поэтому ученый поставил перед собой задачу вывести новые закономерности, которые были бы справедливы в мире элементарных частиц.
Постулаты Бора
Во многом благодаря тому, что существовала модель Резерфорда, атом и его составляющие были неплохо изучены, Нильс Бор смог подойти к созданию своих постулатов. Первый из них гласит о том, что атом имеет стационарные состояния, при которых он не изменяет свою энергию, а электроны при этом движутся по орбитам, не меняя своей траектории. Согласно второму постулату, при переходе электрона с одной орбиты на другую происходит выделение или поглощение энергии. Она равна разности энергий предшествующего и последующего состояний атома. При этом, если электрон перепрыгивает на более близкую к ядру орбиту, то происходит излучение энергии (фотона), и наоборот. Несмотря на то что движение электронов мало напоминает орбитальную траекторию, расположенную строго по окружности, открытие Бора позволило получить великолепное объяснение существованию линейчатого спектра атома водорода. Приблизительно в это же время ученые-физики Герц и Франк, жившие в Германии, подтвердили учение Нильса Бора о существовании стационарных, стабильных состояний атома и возможность изменения значений атомной энергии.

Сотрудничество двух ученых
Кстати, Резерфорд длительное время не мог определить заряд ядра. Ученые Марсден и Гейгер попытались осуществить перепроверку утверждений Эрнеста Резерфорда и в результате подробных и тщательных экспериментов и расчетов пришли к выводу о том, что именно ядро является важнейшей характеристикой атома, и в нем сосредоточен весь его заряд. В дальнейшем было доказано, что значение заряда ядра численно равно порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Интересно, что Нильс Бор вскоре познакомился с Резерфордом и полностью согласился с его взглядами. В последующем ученые длительно работали вместе в одной лаборатории. Модель Резерфорда, атом как система, состоящая из элементарных заряженных частиц, – все это Нильс Бор посчитал справедливым и навсегда отложил в сторону свою электронную модель. Совместная научная деятельность ученых была очень успешной и принесла свои плоды. Каждый из них углубился в изучение свойств элементарных частиц и сделал значимые для науки открытия. Позже Резерфорд обнаружил и доказал возможность разложения ядра, но это уже тема другой статьи.


























