Аммиак – соединение, являющееся важнейшим источником азота для живых организмов, а также нашедшее применение в различных отраслях промышленности. Что такое аммиак, каковы его свойства? Давайте разберемся.
Что такое аммиак: основные характеристики
Аммиак (нитрид водовода) – соединение азота с водородом, имеющее химическую формулу NH3. Форма молекулы напоминает тригональную пирамиду, в вершине которой расположен атом азота.
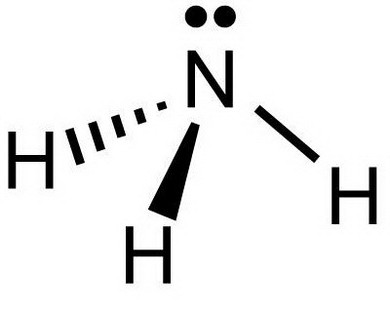
Аммиак представляет собой газ, не имеющий цвета, но обладающий резким специфическим запахом. Плотность аммиака почти в два раза меньше, чем плотность воздуха. При температуре 15 oC она составляет 0,73 кг/м3. Плотность аммиака жидкого в нормальных условиях равна 686 кг/м3. Молекулярная масса вещества - 17,2 г/моль. Отличительной особенностью аммиака является его высокая растворимость в воде. Так, при температуре 0 °C ее значение достигает около 1200 объемов в объеме воды, при 20 °C – 700 объемов. Раствор «аммиак - вода» (аммиачная вода) характеризуется слабощелочной реакцией и довольно уникальным свойством по сравнению с другими щелочами: с увеличением концентрации плотность снижается.
Как образуется аммиак?
Что такое аммиак в организме человека? Это конечный продукт азотистого обмена. Большую его часть печень конвертирует в мочевину (карбамид) – менее токсичное вещество.
Аммиак в природных условиях образуется в результате разложения органических соединений, содержащих азот. Для использования в промышленности это вещество получают искусственным путем.
Получение аммиака в промышленных и лабораторных условиях
В промышленных условиях аммиак получают путем каталитического синтеза из азота и водорода:
N2 + 3H2 → 2NH3 + Q.
Процесс получения вещества проводят при температуре 500 °C и давлении 350 атм. В качестве катализатора используется пористое железо. Полученный аммиак удаляется охлаждением. Азот и водород, которые не прореагировали, возвращаются на синтез.
В лабораторных условиях аммиак получают в основном путем слабого нагревания смеси, состоящей из хлорида аммония и гашеной извести:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O.
Для осушения готовое соединение пропускается через смесь извести и едкого натра. Довольно сухой аммиак можно получить путем растворения в нем металлического натрия и последующей перегонки.
Где используется аммиак?
Нитрид водорода широко применяется в различных отраслях промышленности. Огромные его количества используются для производства азотной кислоты и различных удобрений (мочевина, нитрат аммония и др.), полимеров, синильной кислоты, соды, аммониевых солей и других видов продукции химического производства.

В легкой промышленности свойства аммиака применяют при очистке и окрашивании таких тканей, как шелк, шерсть и хлопок. В сталелитейном производстве он используется для увеличения твердости стали путем насыщения ее поверхностных слоев азотом. В нефтехимической промышленности при помощи нитрида водорода нейтрализуют кислотные отходы.
Благодаря своим термодинамическим свойствам жидкий аммиак используется в качестве хладагента в холодильном оборудовании.
Раствор нитрида водорода (нашатырный спирт) применяется в медицине для выведения из обморочного состояния, стимуляции рвоты, для обработки рук медперсонала, при укусах насекомых и пр.

Некоторые химические свойства аммиака
Нитрид водорода характеризуется довольно высокой химической активностью и способен вступать в реакции со многими веществами.
При взаимодействии аммиака с кислотами образуются соответствующие соли аммония. Так, к примеру, в результате реакции с азотной кислотой образуется аммиачная селитра:
NH3 + HNO3 → NH4NO3.
При взаимодействии с HCl образуется хлорид аммония:
NH3+ HCl → NH4Cl.

Соли аммония представляют собой твердые кристаллические вещества, разлагающиеся в воде и обладающие свойствами, присущими солям металлов. Растворы соединений, образованных в результате взаимодействия аммиака и сильных кислот, имеют слабокислую реакцию.
За счет атомов азота нитрид водорода является активным восстановителем. Восстановительные свойства его проявляются при нагревании. При горении в атмосфере кислорода он образует азот и воду. В присутствии катализаторов взаимодействие с кислородом дает оксид азота. Нитрид водорода имеет способность восстанавливать металлы из оксидов.
Галогены в результате реакции с аммиаком образуют галогениды азота – опасные взрывчатые вещества. При взаимодействии с карбоновыми кислотами и их производными нитрид водорода образует амиды. В реакциях с углем (при 1000 °С) и метаном он дает синильную кислоту.
С ионами металлов аммиак образует аминокомплексы, или аммиакаты (комплексные соединения), имеющие характерную особенность: атом азота всегда связан с тремя атомами водорода. В результате комплексообразования меняется окраска вещества. Так, к примеру, голубой раствор медного купороса при добавлении нитрида водорода приобретает интенсивный сине-фиолетовый цвет. Многие из аминокомплексов обладают достаточной устойчивостью. Благодаря этому они могут быть получены в твердом виде.

В жидком аммиаке хорошо растворяются как ионные, так и неполярные неорганические и органические соединения.
Санитарно-гигиенические характеристики
Аммиак относят к четвертому классу опасности. Предельно допустимая максимально-разовая концентрация (ПДК) в воздухе населенных пунктов равна 0,2 мг/м3, среднесуточная – 0,04. В воздухе рабочей зоны содержание аммиака не должно быть выше 20 мг/м³. При таких концентрациях запах вещества не ощущается. Фиксироваться человеческим обонянием он начинает при 37 мг/м³. То есть если запах аммиака ощущается, это означает, что допустимые нормы нахождения вещества в воздухе значительно превышены.
Влияние на человеческий организм
Что такое аммиак с точки зрения воздействия на человека? Это токсикант. Его относят к веществам, способным оказывать удушающее и нейротропное действие, ингаляционное отравление которыми может привести к отеку легких и поражению нервной системы.
Аммиачные пары раздражающе воздействуют на кожные покровы, слизистые оболочки глаз и органов дыхания. Концентрация вещества, при которой проявляется раздражение зева, составляет 280 мг на куб. метр, глаз − 490 мг на куб. метр. В зависимости количества нитрида водорода в воздухе могут возникать першение в горле, затрудненность дыхания, приступы кашля, боль в глазах, обильное слезотечение, химический ожог роговицы, потеря зрения. При содержании аммиака 1,5 г на куб. метр в течение часа развивается токсический отек легких. При контакте жидкого аммиака и его растворов (в высоких концентрациях) с кожей возможны покраснения, зуд, жжение, дерматиты. Так как сжиженный нитрид водовода при испарении поглощает тепло, возможны обморожения различной степени.
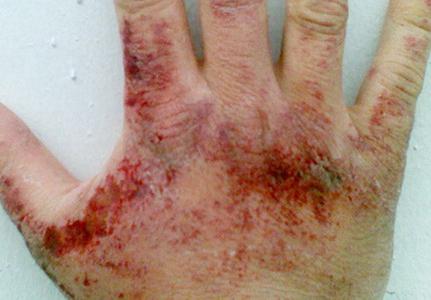
Симптомы отравления аммиаком
Отравление данным токсикантом может вызывать снижение слухового порога, тошноту, головокружение, головную боль и пр. Возможны изменения в поведении, в частности сильное возбуждение, бред. Проявление симптомов в ряде случаев имеет прерывистый характер. Они могут на некоторое время прекращаться, а потом возобновляться с новой силой.
Учитывая все возможные последствия воздействия аммиака, очень важно соблюдать меры предосторожности при работе с данным веществом и не допускать превышения его концентрации в воздушной среде.


























