Существует четыре наиболее важных класса органических соединений, которые входят в состав организма: нуклеиновые кислоты, жиры, углеводы и белки. О последних и пойдет речь в этой статье.
Что такое белок?
Это полимерные химические соединения, построенные из аминокислот. Белки имеют сложную структуру.
Как синтезируется белок?
Это происходит в клетках организма. Существуют специальные органоиды, которые отвечают за этот процесс. Это рибосомы. Они состоят из двух частей: малой и большой, которые объединяются во время работы органеллы. Процесс синтезирования полипептидной цепочки из аминокислот называется трансляцией.
Какие бывают аминокислоты?
Несмотря на то что разновидностей белков в организме несметное количество, аминокислот, из которых они могут быть сформированы, существует всего двадцать. Такое разнообразие белков достигается за счет различных комбинаций и последовательности этих аминокислот, а также разного размещения построенной цепочки в пространстве.
Аминокислоты содержат в своем химическом составе две противоположные по своим свойствам функциональные группы: карбоксильную и аминогруппу, а также радикал: ароматический, алифатический или гетероциклический. Кроме того, в состав радикалов могут входить дополнительные функциональные группы. Это могут быть карбоксильные группы, аминогруппы, амидные, гидроксильные, гуанидовые группы. Также радикал может содержать в своем составе серу.
Вот список кислот, из которых могут быть построены белки:
- аланин;
- глицин;
- лейцин;
- валин;
- изолейцин;
- треонин;
- серин;
- глутаминовая кислота;
- аспарагиновая кислота;
- глутамин;
- аспарагин;
- аргинин;
- лизин;
- метионин;
- цистеин;
- тирозин;
- фенилаланин;
- гистидин;
- триптофан;
- пролин.
Из них десять являются незаменимыми — такими, которые не могут быть синтезированы в организме человека. Это валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, аргинин. Они обязательно должны поступать в организм человека с пищей. Много таких аминокислот содержится в рыбе, говядине, мясе, орехах, бобовых.
Первичная структура белка — что это такое?
Это последовательность аминокислот в цепочке. Зная первичную структуру белка, можно составить точную его химическую формулу.

Вторичная структура
Это способ скручивания полипептидной цепочки. Существует два варианта конфигурации белка: альфа-спираль и бета-структура. Вторичная структура белка обеспечивается водородными связями между СО- и NH- группами.
Третичная структура белка
Это пространственная ориентация спирали или способ ее укладки в определенном объеме. Ее обеспечивают дисульфидные и пептидные химические связи.
В зависимости от типа третичной структуры существуют фибриллярные и глобулярные белки. Последние имеют шаровидную форму. Структура фибриллярных белков напоминает нить, которая формируется путем многослойной укладки бета-структур или параллельного расположения нескольких альфа-структур.
Четвертичная структура
Она свойственна для белков, которые имеют в своем составе не одну, а несколько полипептидных цепочек. Такие белки называются олигомерными. Отдельные цепочки, входящие в их состав, называют протомерами. Протомеры, из которых построен олигомерный белок, могут обладать как одинаковой, так и разной первичной, вторичной или третичной структурой.
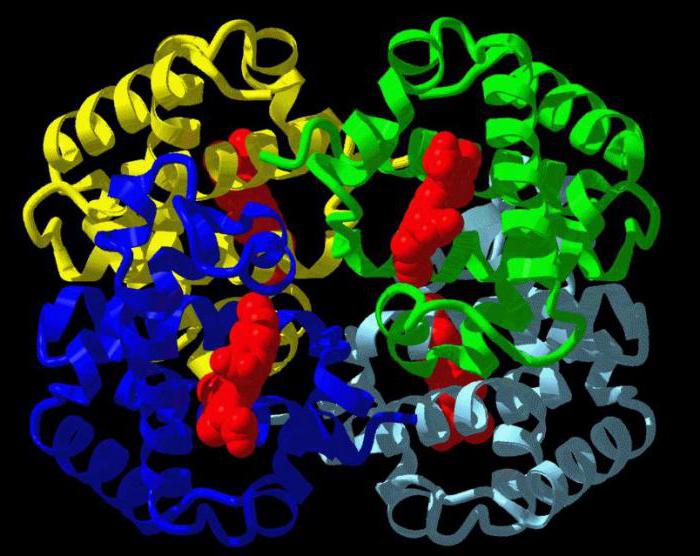
Что такое денатурация?
Это разрушение четвертичной, третичной, вторичной структур белка, вследствие чего он теряет свои химические, физические свойства и больше не может выполнять свою роль в организме. Этот процесс может происходить в результате действия на белок высоких температур (от 38 градусов Цельсия, но для каждого белка эта цифра индивидуальна) или агрессивных веществ, таких как кислоты и щелочи.
Некоторые белки способны к ренатурации — возобновлению своей первоначальной структуры.
Классификация белков
Учитывая химический состав, их разделяют на простые и сложные.
Простые белки (протеины) — это те, в состав которых входят только аминокислоты.
Сложные белки (протеиды) — те, которые имеют в своем составе простетическую группу.
В зависимости от вида простетической группы белки можно разделить на:
- липопротеиды (содержат липиды);
- нуклеопротеиды (в составе есть нуклеиновые кислоты);
- хромопротеиды (содержат пигменты);
- фосфопротеиды (имеют в составе фосфорную кислоту);
- металлопротеиды (содержат металлы);
- гликопротеиды (в составе есть углеводы).
Кроме того, в зависимости от типа третичной структуры существует глобулярный и фибриллярный белок. Оба могут быть как простыми, так и сложными.
Свойства фибриллярных белков и их роль в организме
Их можно разделить на три группы в зависимости от вторичной структуры:
- Альфа-структурные. К ним относится кератины, миозин, тропомиозин и другие.
- Бета-структурные. Например, фиброин.
- Коллаген. Это белок, который обладает особой вторичной структурой, которая не является ни альфа-спиралью, ни бета-структурой.
Особенности фибриллярных белков всех трех групп заключаются в том, что они обладают нитевидной третичной структурой, а также не растворимы в воде.
Поговорим об основных фибриллярных белках подробнее по порядку:
- Кератины. Это целая группа разнообразных белков, которые являются главной составляющей волос, ногтей, перьев, шерсти, рогов, копыт и т. д. Кроме того, фибриллярный белок этой группы цитокератин входит в состав клеток, формируя цитоскелет.
- Миозин. Это вещество, которое входит в состав мышечных волокон. Наряду с актином, этот фибриллярный белок является сократительным и обеспечивает функционирование мышцы.
- Тропомиозин. Это вещество состоит из двух переплетенных альфа-спиралей. Он также входит в состав мышц.
- Фиброин. Этот белок выделяется многими насекомыми и паукообразными. Он является основной составляющей паутины и шелка.
- Коллаген. Это наиболее распространенный фибриллярный белок в организме человека. Он входит в состав сухожилий, хрящей, мышц, сосудов, кожи и т. д. Это вещество обеспечивает эластичность тканей. Выработка коллагена в организме с возрастом снижается, в связи с чем возникают морщины на коже, ослабевают сухожилия и связки и т. д.
Далее рассмотрим вторую группу белков.
Глобулярные белки: разновидности, свойства и биологическая роль
Вещества данной группы имеют форму шара. Они могут быть растворимыми в воде, растворах щелочей, солей и кислот.
Наиболее распространенными глобулярными белками в организме являются:
- Альбумины: овальбумин, лактальбумин и др.
- Глобулины: белки крови (напр., гемоглобин, миоглобин) и др.
Подробнее о некоторых из них:
- Овальбумин. Из этого белка на 60 процентов состоит яичный белок.
- Лактальбумин. Основная составляющая молока.
- Гемоглобин. Это сложный глобулярный белок, в составе которого в качестве простетической группы присутствует гем — это пигментная группа, содержащая железо. Гемоглобин содержится в эритроцитах. Это белок, который способен связываться с кислородом и транспортировать его.
- Миоглобин. Это белок, похожий на гемоглобин. Он выполняет ту же функцию — перенос кислорода. Такой белок содержится в мышцах (поперечнополосатых и сердечной).