Алканы, алкены, алкины - это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины - это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин - этин (ацетилен). Он обладает вот такой химической формулой - С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.
Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, - твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Растворимость в органических растворителях высокая.
Наиболее широко используемый алкин - ацетилен - обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения - минус 83,6 градусов Цельсия;
Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
2Н2 + C3H4 = С3Н8
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй - столько же.
Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
С2Н2 + 2СІ2 = С2Н2СІ4
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
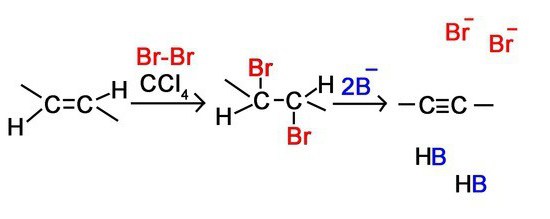
Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
С2Н2 + НСІ = С2Н3СІ
С2Н2СІ + НСІ = С2Н4СІ2
Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
H2O + С2Н2 = С2Н3ОН
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
2С2Н2 +2О2 = 2Н2О + 3С + СО2
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
4О2 + С3Н4 = 2Н2О + 3СО2
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
С2Н2 + 2AgNO3 = Ag2C2 + 2NH4NO3 + 2Н2О
Еще один интересный процесс с участием алкинов - реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
3С2Н2 = С6Н6
Также возможна полимеризация алкинов - процесс объединения нескольких молекул вещества в одну полимерную.
Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый - это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
C2H4Br2 + 2КОН = С2Н2 + 2Н2О + 2KBr
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
СаС2 + Н2О = С2Н2 + 2Са(ОН)2
Следующий метод получения алкинов - дегидрирование. Вот пример такой реакции:
2СН4 = 3Н2 + С2Н2
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин - этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
| Название реакции | Пояснения | Пример уравнения |
| Галогенирование | Реакция присоединения молекулой ацетиленового углеводорода атомов галогенов (брома, иода, хлора и др.) | C4H6 + 2I2 = С4Н6І2 |
| Гидрирование | Реакция присоединения молекулой алкина атомов водорода. Происходит в две стадии. | C3H4 + Н2 = С3Н6 C3H6 + Н2 = С3Н8 |
| Гидрогалогенирование | Реакция присоединения молекулой ацетиленового углеводорода гидрогалогенов (НІ, НСІ, HBr). Происходит в две стадии. | C2H2 + НІ = С2Н3І С2Н3І + НІ = C2H4I2 |
| Гидратация | Реакция, в основе которой лежит взаимодействие с водой. Происходит в две стадии. | С2Н2 + H2O = С2Н3ОН C2H3OH = СН3-СНО |
| Полное окисление (горение) | Взаимодействие ацетиленовго углеводорода с кислородом при повышенной температуре. В результате образуется оксид карбона и вода. | 2C2H5 + 5О2 = 2Н2О + 4CO2 2С2Н2 + 2О2 = Н2О + CO2 + 3С |
| Реакции с солями металлов | Заключаются в том, что атомы металлов замещают атомы гидрогена в молекулах ацетиленовых углеводородов. | С2Н2 + AgNO3 = C2Ag2 + 2NH4NO3 + 2Н2О |
Получить алкины можно в лабораторных условиях тремя методами:
- из неорганических соединений;
- путем дегидрирования органических веществ;
- способом дегидрогалогенирования органических веществ.
Вот мы и рассмотрели все физические и химические характеристики алкинов, способы их получения, области применения в промышленности.


























