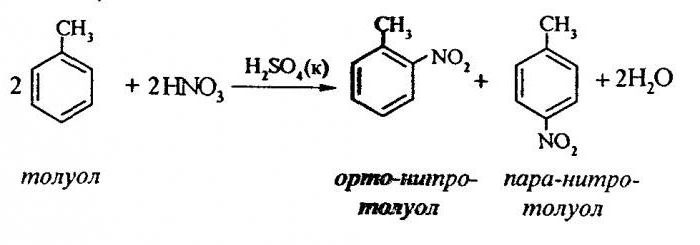
Поговорим о том, как осуществляется нитрование толуола. Получают подобным взаимодействием огромное количество полуфабрикатов, используемых в изготовлении взрывчатых веществ, фармацевтических препаратов.
Значимость нитрования
Производные бензола в виде ароматических нитросоединений выпускаются в современной химической промышленности. Нитробензол является полупродуктом в анилинокрасочном, парфюмерном, фармацевтическом производстве. Он является отличным растворителем для многих органических соединений, включая и нитрит целлюлозы, формируя с ним желатинообразную массу. В нефтяной промышленности его применяют в качестве очистителя для смазочных масел. При нитровании толуола получают бензидин, анилин, аминосалициловую кислоту, фенилендиамин.

Характеристика нитрования
Нитрование характеризуется вводом группы NO2 в молекулу органического соединения. В зависимости от исходного вещества протекает данный процесс по радикальному, нуклеофильному, электрофильному механизму. В качестве активных частиц выступают катионы нитрония, ионы и радикалы NO2. Реакция нитрования толуола относится к замещению. Для других органических веществ возможно заместительное нитрование, а также присоединение по двойной связи.
Нитрование толуола в молекуле ароматического углеводорода осуществляется с помощью нитрующей смеси (серной и азотной кислот). Каталитические свойства проявляет серная кислота, выступающая в данном процессе в качестве водотнимающего средства.
Уравнение процесса
Нитрование толуола предполагает замещение одного водородного атома нитрогруппой. Как выглядит схема протекающего процесса?
Для того чтобы описать нитрование толуола, уравнение реакции можно представить в следующем виде:
ArH + HONO2+ = Ar-NO2 +H2 O
Оно позволяет судить только об общем ходе взаимодействия, но не раскрывает всех особенностей данного процесса. На самом деле происходит реакция между ароматическими углеводородами и продуктами азотной кислоты.
Учитывая, что в продуктах есть молекулы воды, это приводит к снижению концентрации азотной кислоты, поэтому нитрование толуола замедляется. Для того чтобы избежать подобной проблемы, осуществляют данный процесс при невысоких температурах, используя азотную кислоту в избыточном количестве.
Помимо серной кислоты, в качестве водоотнимающих средств применяют уксусный ангидрид, полифосфорные кислоты, трехфтористый бор. Они дают возможность снизать расход азотной кислоты, повышают эффективность взаимодействия.

Нюансы процесса
Нитрование толуола было описано в конце девятнадцатого века В. Марковниковым. Ему удалось установить связь между присутствием в реакционной смеси концентрированной серной кислоты и скоростью протекания процесса. В современном производстве нитротолуола применяют безводную азотную кислоту, взятую в некотором избытке.
Кроме того, сульфирование и нитрование толуола связано с использованием доступного водоотнимающего компонента фторида бора. Его введение в реакционный процесс позволяет снижать стоимость получаемого продукта, что делает доступным нитрование толуола. Уравнение протекающего процесса в общем виде представлено ниже:
ArH + HNO3 + BF3= Ar-NO2 + BF3 ·H2 O
После завершения взаимодействия вводят воду, благодаря чему моногидрат фторида бора образует дигидрат. Его отгоняют в вакууме, затем добавляют фтористый кальций, возвращая соединение в исходный вид.
Специфика нитрования
Есть некоторые особенности данного процесса, связанные с выбором реагентов, субстракта реакции. Рассмотрим некоторые их варианты подробнее:
- 60-65 процентная азотная кислота в смеси с 96 процентной серной кислотой;
- смесь 98 % азотной кислоты и концентрированной серной кислот подходит для мало реакционных органических веществ;
- нитрат калия или аммония с концентрированной серной кислотой - это отличный выбор для производства полимерных нитросоединений.
Кинетика нитрования
Ароматические углеводороды, взаимодействующие со смесью серной и азотной кислот, нитруются по ионному механизму. В. Марковникову удалось охарактеризовать специфику данного взаимодействия. Процесс протекает в несколько стадий. Сначала образуется нитросерная кислота, которая подвергается диссоциации в водном растворе. Ионы нитрония вступают во взаимодействие с толуолом, образуя в качестве продукта нитротолуол. При добавлении в смесь молекул воды происходит замедление процесса.
В растворителях с органической природой - нитрометане, ацетонитриле, сульфолане - образование этого катиона позволяет увеличивать скорость нитрования.
Полученный катион нитрония прикрепляется к ядру ароматического толуола, при этом образуется промежуточное соединение. Далее происходит отрыв протона, приводящий к формированию нитротолуола.
Для детального описания происходящего процесса можно рассмотреть образование «сигма» и «пи» комплексов. Образование «сигма» комплекса является лимитирующей стадией взаимодействия. Скорость реакции будет напрямую связана с быстротой присоединения катиона нитрония к атому углерода в ядре ароматического соединения. Отщепление протона от толуола осуществляется практически мгновенно.
Только в некоторых ситуациях могут возникать какие-то проблемы с замещением, связанные с существенным первичным кинетическим изотопным эффектом. Это связано с ускорением обратного процесса при наличии препятствий разного вида.
При выборе в качестве катализатора и водоотнимающего средства концентрированной серной кислоты наблюдается смещение равновесия процесса в сторону образования продуктов реакции.
Заключение
При нитровании толуола образуется нитротолуол, который является является ценным продуктом химической промышленности. Именно это вещество является взрывчатым соединением, поэтому востребовано на взрывных работах. Среди экологических проблем, связанных с его промышленным изготовлением, отметим использование существенного количества концентрированной серной кислоты.
Для того чтобы справиться с такой проблемой, химики ищут способы уменьшения сернокислотных отходов, получаемых после проведения процесса нитрования. Например, процесс осуществляют при пониженных температурах, применяют легко регенерируемые среды. Серная кислота обладает сильными окислительными свойствами, что негативно отражается на коррозии металлов, представляет повышенную опасность для живых организмов. При соблюдении всех норм безопасности можно справиться с этими проблемами, получать нитросоединения высокого качества.


























