Здесь читатель найдет сведения о галогенах, химических элементах периодической таблицы Д. И. Менделеева. Содержание статьи позволит вам ознакомиться с их химическими и физическими свойствами, нахождением в природе, способах применения и др.
Общие сведенья
Галогены – это все элементы химической таблицы Д. И. Менделеева, находящиеся в семнадцатой группе. По более строму способу классификации это все элементы седьмой группы, главной подгруппы.
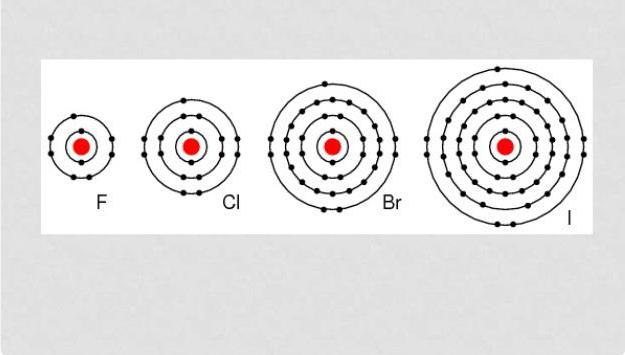
Галогены – это элементы, способные вступать в реакции практически со всеми веществами простого типа за исключением некоторого количества неметаллов. Все они являются энергетическими окислителями, потому в условиях природы, как правило, находятся в смешанной форме с другими веществами. Показатель химической активности галогенов уменьшается с возрастанием их порядковой нумерации.
Галогенами считаются следующие элементы: фтор, хлор, бром, йод, астат и искусственно созданный теннесин.
Как говорилось ранее, все галогены – это окислители с ярко выраженными свойствами, к тому же все они являются неметаллами. Внешний энергетический уровень имеет семь электронов. Взаимодействие с металлами приводит к образованию ионной связи и солей. Почти все галогены, за исключением фтора, могут проявлять себя в качестве восстановителя, достигая высшей окислительной степени +7, однако для этого необходимо, чтобы они взаимодействовали с элементами, имеющими большую степень электроотрицательности.
Особенности этимологии

В 1841 г. шведский ученый-химик Й. Берцелиус предложил ввести термин галогенов, относя к ним известные в то время F, Br, I. Однако до введения этого термина по отношению ко всей группе таких элементов, в 1811 г., немецкий ученый И. Швейггер этим же словом назывался хлор, сам термин переводился с греческого языка как «солерод».
Атомное строение и окислительные степени
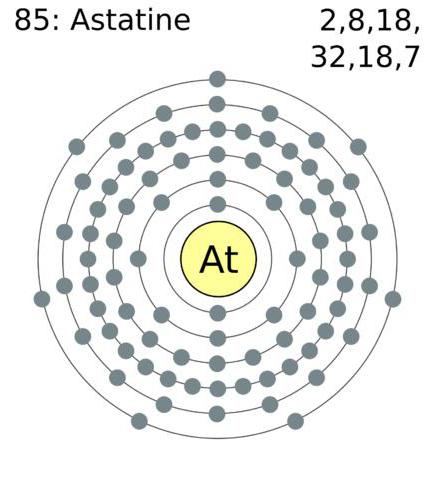
Конфигурация электронов внешней атомной оболочки галогенов имеет следующий вид: астат – 6s26p5, йод – 5s25p5, бром 4s24p5, хлор – 3s23p5, фтор 2s22p5.
Галогены – это элементы, имеющие на электронной оболочке внешнего типа семь электронов, что позволяет им «без особых усилий» присоединять электрон, которого недостаточно для завершения оболочки. Обычно степень окисления проявляется в виде -1. Cl, Br, I и At вступая в реакцию с элементами, имеющими более высокую степень, начинают проявлять положительную окислительную степень: +1, +3, +5, +7. Фтор имеет постоянную окислительную степень -1.
Распространение
Ввиду своей высокой степени реакционной способности галогены обычно находятся в виде соединений. Уровень распространения в коре земли убывает в соответствии с увеличением атомного радиуса от F к I. Астат в коре земли измеряется вовсе в граммах, а теннессин создается искусственно.
Галогены встречаются в природе чаще всего в соединениях галогенидов, а йод также может принимать форму йодата калия или натрия. В связи со своей растворимостью в воде присутствуют в океанических водах и рассолах природного происхождения. F – малорастворимый представитель галогенов и чаще всего обнаруживается в породах осадочного типа, а его главный источник – это фторид кальция.
Физические качественные характеристики
Галогены между собой могут сильно отличаться, и они имеют следующие физические свойства:
- Фтор (F2) – это газ светло-желтого цвета, имеет резкий и раздражающий запах, а также не подвергается сжатию в обычных температурных условиях. Температура плавления равна -220 °С, а кипения -188 °С.
- Хлор (Cl2) представляет собой газ, не сжимающийся при обычной температуре, даже находясь под воздействием давления, имеет удушливый, резкий запах и зелено-желтый окрас. Плавиться начинает при -101 °С, а кипеть при -34 °С.
- Бром (Br2) – это летучая и тяжелая жидкость с буро-коричневым цветом и резким зловонным запахом. Плавится при -7 °С, а кипит при 58 °С.
- Йод (I2) – это вещество твердого типа имеет тёмно-серый окрас, и ему свойственен металлический блеск, запах довольно резкий. Процесс плавления начинается при достижении 113,5 °С, а кипит при 184,885 °С.
- Редкий галоген – это астат (At2), который является твердым веществом и имеет черно-синий цвет с металлическим блеском. Температура плавления соответствует отметке в 244 °С, а кипение начинается после достижения 309 °С.

Химическая природа галогенов
Галогены – это элементы с очень высокой окислительной активностью, которая ослабевает в направлении от F к At. Фтор, будучи самым активным представителем галогенов, реагировать может со всеми видами металлов, не исключая ни один известный. Большинство представителей металлов, попадая в атмосферу фтора, подвергаются самовоспламенению, при этом выделяя теплоту в огромных количествах.
Без подвергания фтора нагреванию он может реагировать с большим количеством неметаллов, например H2, C, P, S, Si. Тип реакций в таком случае является экзотермическим и может сопровождаться взрывом. Нагреваясь, F принуждает окисляться остальные галогены, а подвергаясь облучению, этот элемент способен и вовсе реагировать с тяжелыми газами инертной природы.
Вступая во взаимодействие с веществами сложного типа, фтор вызывает высоко энергетические реакции, например, окисляя воду, он может вызывать взрыв.

Реакционноспособным может быть и хлор, особенно в свободном состоянии. Уровень активности его меньше, чем у фтора, но он способен реагировать почти со всеми простыми веществам, но азот, кислород и благородные газы в реакцию не вступают с ним. Взаимодействуя с водородом, при нагревании или хорошем освещении хлор создает бурнопротекающую реакцию, сопровождаемую взрывом.
В реакциях присоединения и замещения Cl может реагировать с большим количеством веществ сложного типа. Способен вытеснять Br и I в результате нагревания из соединений, созданных ими с металлом или водородом, а также может вступать в реакцию со щелочными веществами.
Бром химически менее активный, чем хлор или фтор, но все же весьма ярко себя проявляет. Это обусловлено тем, что чаще всего бром Br используется в качестве жидкости, ведь в таком состоянии исходная степень концентрации при остальных одинаковых условиях выше, чем у Cl. Широко используется в химии, особенно органической. Может растворяться в H2O и реагировать с ней частично.
Галоген-элемент иод образует простое вещество I2 и способен вступать в реакции с H2O, растворяется в йодидах растворов, образуя при этом комплексные анионы. От большинства галогенов I отличается тем, что он не вступает в реакции с большинством представителей неметаллов и не спеша реагирует с металлами, при этом его необходимо нагревать. С водородом реагирует, лишь подвергаясь сильному нагреванию, а реакция является эндотермической.
Редкий галоген астат (At) проявляет реакционные способности меньше йода, однако может реагировать с металлами. В результате диссоциации возникают как анионы, так и катионы.
Области применения
Соединения галогенов широко применяются человеком в самых разнообразных областях деятельности. Природный криолит (Na3AlF6) используют для получения Al. Бром и йод в качестве простых веществ часто используют фармацевтические и химические компании. При производстве запчастей для машин часто используют галогены. Фары – это одна из таких деталей. Качественно выбрать материал для данной составной части машины очень важно, так как фары освещают дорогу в ночное время и являются способом обнаружения как вас, так и других автомобилистов. Одним из лучших составных материалов для создания фар считается ксенон. Галоген тем не менее ненамного уступает по качеству этому инертному газу.

Хороший галоген – это фтор, добавка, широко используемая при производстве зубных паст. Он помогает предотвращать возникновение заболевания зубов – кариеса.
Такой элемент-галоген, как хлор (Cl), находит свое применение в получении HCl, часто используется при синтезе органических веществ, таких как пластмасса, каучук, синтетические волокна, красители и растворители и т. д. А также соединения хлора используют в качестве отбеливателей льняного и хлопчатобумажного материала, бумаги и как средство для борьбы с бактериями в питьевой воде.

Внимание! Токсично!
Ввиду наличия очень высокой реакционной способности галогены по праву называются ядовитыми. Наиболее ярко способность к вступлению в реакции выражена у фтора. Галогены имеют ярко выраженные удушающие свойства и способны поражать ткани при взаимодействии.
Фтор в парах и аэрозолях считается одним из самых потенциально опасных форм галогенов, вредоносных для окружающих живых существ. Это связано с тем, что он слабо воспринимается обонянием и ощущается лишь по достижении большой концентрации.
Подводя итоги
Как мы видим, галогены являются очень важной частью периодической таблицы Менделеева, они имеют множество свойств, отличаются между собой по физическим и химическим качествам, атомному строению, степени окисления и способности реагировать с металлами и неметаллами. В промышленности используются разнообразным образом, начиная от добавок в средства личной гигиены и заканчивая синтезом веществ органической химии или отбеливателями. Несмотря на то что одним из лучших способов поддержания и создания света в фаре автомобиля является ксенон, галоген тем не менее ему практически не уступает и также широко используется и имеет свои преимущества.
Теперь вы знаете, что такое галоген. Сканворд с любыми вопросами об этих веществах для вас уже не помеха.


























