Каталаза – фермент, обнаруженный почти во всех живых организмах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
Общие сведения
Фермент каталаза относится к оксидоредуктазам – обширному классу ферментов, которые катализируют перенос электронов от молекулы-восстановителя (донора) к молекуле-окислителю (акцептору).
Оптимальный pH для работы каталазы в человеческом организме около 7, однако, скорость реакции существенно не изменяется при значениях показателя водорода от 6,8 до 7,5. Оптимальное значение рН для других каталаз колеблется от 4 до 11, в зависимости от вида организма. Оптимальная температура также различается, для человека это около 37о С.
Каталаза - один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов.
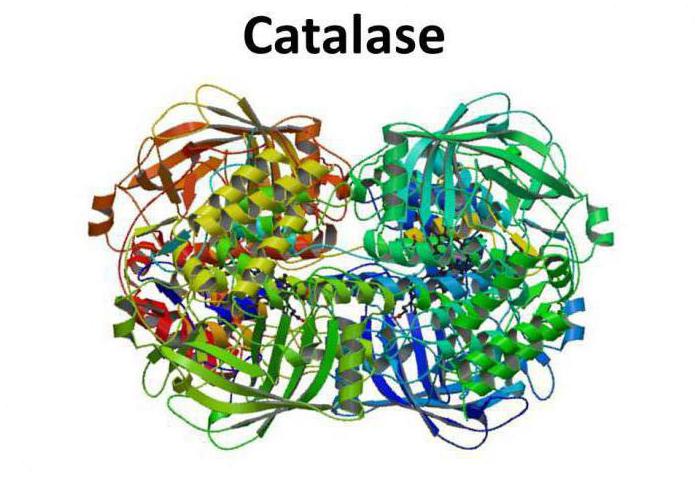
Структура фермента
Каталаза представляет собой тетрамер из четырех полипептидных цепей, каждая из которых имеет длину более 500 аминокислот. Фермент имеет в составе четыре группы порфирового гема, благодаря которым и вступает в реакцию с активными формами кислорода. Окисленный гем представляет собой простетическую группу каталазы.
История открытия
Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.

В 1900 году немецкий химик Оскар Лев первым ввел термина «каталаза» для обозначения таинственного вещества, разлагающего перекиси. Он же сумел ответить на вопрос, где содержится фермент каталаза. В результате многочисленных экспериментов Оскар Лев выявил, что данный фермент характерен почти для всех животных и растительных организмов. В живой клетке, как и многие другие ферменты, каталаза содержится в пероксисомах.
В 1937 году впервые удалось кристаллизоваться каталазу из говяжьей печени. В 1938 году была определена молекулярная масса фермента – 250 кДа. В 1981 году ученые получили изображение трехмерной структуры бычьей каталазы.
Катализ перекиси водорода
Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным.
Реакция разложения пероксида водорода в живых тканях:
2 H2O2 → 2 H2O + O2
Молекулярный механизм расщепления перекиси водорода ферментом каталазой пока точно не изучен. Предполагается, что реакция проходит в два этапа - на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода.
Благодаря такому действию фермента каталазы на пероксид водорода, наличие этого активного вещества в образцах ткани легко определить. Для этого достаточно добавить к исследуемому образцу небольшое количество перекиси водорода и наблюдать за реакцией. О наличии фермента говорит формирование пузырьков кислорода. Эта реакция хороша тем, что не требует никакого специального оборудования или инструментов - ее можно наблюдать невооруженным глазом.

Стоит заметить, что ион любого тяжелого металла может выступать как неконкурентный ингибитор каталазы. Кроме того, всем известный цианид ведет себя как конкурентный ингибитор каталазы, если в тканях много перекиси водорода. Арсенаты играют роль активаторов.
Применение
Разлагающее действие фермента каталазы на пероксид водорода нашло применение в пищевой промышленности – с помощью этого фермента из молока удаляется Н2О2 до приготовления сыра. Еще одно применение – специальные пищевые упаковки, которые защищают продукты от окисления. Каталаза также применяется в текстильной промышленности для удаления пероксида водорода из тканей.
Она в небольших количествах используется в гигиене контактных линз. Некоторые дезинфицирующие средства имеют в составе перекись водорода, и каталаза используется для расщепления этого компонента перед повторным использованием линз.
Активность
Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей.
Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда - каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители. Это неожиданное открытие сейчас проверяется исследователями, и, возможно, сыграет роль в разработке препаратов, приостанавливающих поседение волос.


























