В наше время физика стала очень распространенной наукой. В буквальном смысле она присутствует везде. Самый элементарный пример: в вашем дворе растет яблоня, а на ней спеют фрукты, приходит время и яблоки начинают опадать, но в каком направлении они падают? Благодаря закону всемирного тяготения наш плод падает на землю, то есть направляется вниз, но не вверх. Это был один из самых известных примеров физики, но давайте обратим внимание на термодинамику, а если точнее, то на фазовые равновесия, которые не менее важны в нашей жизни.
Термодинамика

Для начала, давайте рассмотрим этот термин. Θερμοδυναμική- так выглядит слово на греческом языке. Первая часть Θερμо обозначает «тепло», а вторая δυναμική- «сила». Термодинамика – это раздел физики, который изучает свойства макроскопической системы, а также различные способы превращения и передачи энергии. В этом разделе специально изучаются различные состояния и процессы для того, чтобы в описание можно было ввести понятие температура (это физическая величина, которая характеризует термодинамическую систему и измеряется при помощи определенных приборов). Все происходящие процессы в термодинамических системах описываются только микроскопическими величинами (давление и температура, а также концентрация компонентов).
Уравнение Клапейрона-Клаузиуса
Каждый физик знает это уравнение, но давайте мы его разберем по частям. Оно относится к равновесным процессам перехода определенной материи из одной фазы в другую. Это прекрасно видно на таких примерах: плавление, испарение, сублимация (один из способов консервации продуктов, который проходит путем полного удаления влаги). По формуле хорошо видно происходящие процессы:
- n= PV/RT;
- где Т-температура вещества;
- Р-давление;
- R-удельная теплота фазового перехода;
- V-изменение удельного объема.
История создания уравнения

Уравнение Клапейрона-Клаузиуса является прекрасным математическим объяснением второго закона термодинамики. Также упоминается как «неравенство Клаузиуса». Естественно, теорема была разработана самим ученым, который хотел объяснить взаимосвязь между тепловым потоком в системе и энтропией, а также ее окружение. Это уравнение Клаузиус разработал в своих попытках объяснить энтропию и определить ее в количествах. В прямом смысле теорема дает нам возможность определить, является ли циклический процесс обратимым или он необратим. Эта неравенство предлагает нам количественную формулу для понимания второго закона.
Ученый был одним из первых, кто работал над идеей энтропии, и даже дал этому процессу название. То, что сейчас известно, как теорема Клаузиуса, впервые было опубликовано в 1862 году в шестом труде Рудольфа «Об использовании теоремы эквивалентности преобразований для работы в интерьере». Ученый пытался показать пропорциональную зависимость между энтропией и потоком энергии путем нагревания (δ Q) в системе. В построении эта тепловая энергия может быть преобразована в работу, и она может быть трансформирована в тепло через циклический процесс. Рудольф доказал, что «алгебраическая сумма всех преобразований, происходящих в циклическом процессе, может быть только меньше нуля или, в крайнем случае, равна нулю».
Замкнутая изолированная система
Изолированная система является одним из следующих способов:
- Физическая система далека от других, которые не взаимодействуют с ними.
- Термодинамическая система закрыта жесткими неподвижными стенками, через которые ни материя, ни энергия не может пройти.
Несмотря на то что субъект внутренне относится к своей собственной гравитации, изолированную систему обычно принимают за пределы внешних гравитационных и других дальних сил.
Это может быть противопоставлено тому, что (в более общей терминологии, используемой в термодинамике) называется замкнутой системой, охватываемой выборочными стенками, через которые можно передавать энергию в виде тепла или работы, но не материи. И с открытой системой, в которую материя и энергия входят или выходят, хотя у нее могут быть различные непроницаемые стены в частях ее границ.
Изолированная система подчиняется закону сохранения. Чаще всего в термодинамике вещество и энергия рассматриваются как отдельные понятия.
Термодинамические переходы
Чтобы понять квантовые фазовые переходы, полезно сопоставить их с классическими трансформациями (также называемыми тепловыми обращениями). CPT описывает точку возврата в термодинамических свойствах системы. Он сигнализирует о реорганизации частиц. Типичным примером является замерзающий переход воды, который описывает плавное превращение между жидкостью и твердым телом. Классические фазовые перерастания обусловлены конкуренцией между энергией системы и энтропией ее тепловых флуктуаций.
Классическая система не имеет энтропии при нулевой температуре и, следовательно, не может произойти фазовое превращение. Их порядок определяется первым разрывным производным термодинамическим потенциалом. И, конечно же, имеет первый порядок. Фазовые превращения от ферромагнетика к парамагнетику является непрерывным и имеет второй порядок. Эти постоянные изменения от упорядоченной к неупорядоченной фазе описываются параметром порядка, которые равны нулю. Для вышеупомянутого ферромагнитного превращения параметр порядка будет представлять собой полную намагниченность системы.
Потенциал Гиббса
Свободная энергия Гиббса - это максимальное количество работ без расширения, которые могут быть убраны из термодинамической закрытой системы (которая может обменивать тепло и работать с окружающей средой). Такой максимальный результат может быть получен только в полностью обратимом процессе. Когда система трансформируется обратным образом из первого состояния во второе, уменьшение свободной энергии Гиббса равно выполняемой системой в ее окружении, за вычетом работы сил давления.
Состояния равновесия

Термодинамическое и механическое равновесие является аксиоматической концепцией термодинамики. Это внутреннее состояние одной или нескольких систем, которые соединены более или менее проницаемыми или непроницаемыми стенками. В данном состоянии нет чистых макроскопических потоков из материи или энергии, либо в рамках системы или между системами.
В своей собственной концепции состояния внутренних равновесий макроскопическое изменение не происходит. Системы одновременно находятся во взаимных тепловых, механических, химических (константах), радиационных равновесиях. Они могут быть в одном виде. В этом процессе все виды сохраняются сразу и бесконечное количество времени до тех пор, пока не будет нарушена физическая операция. В макроскопическом равновесии происходят совершенно точные сбалансированные обмены. Выше приведенные доказательство - это физическое объяснение данного понятия.
Основы
Каждые законы, теоремы, формулы имеют свои основы. Давайте разберем 3 основы закона фазового равновесия.
- Фаза представляет собой форму материи, однородную по химическому составу, физическому состоянию и механическому равновесию. Типичные фазы - твердые, жидкие и газообразные. Две несмешивающиеся жидкости (или жидкие смеси с различными составами), разделенные отдельной границей, считаются двумя разными фазами и несмешивающимися твердыми частицами.
- Количество компонентов (С) - это число химически независимых составляющих системы. Минимальное количество независимых видов, необходимых для определения состава всех фаз системы.
- Число степеней свободы (F) в этом контексте - это число интенсивных переменных, которые не зависят друг от друга.
Классификация по фазовым равновесиям
- Реакции сплошного чистого переноса (часто называемые твердофазными реакциями) происходят между твердыми материями различного состава. Они могут включать элементы, обнаруженные в жидкостях (H, C), но эти элементы сохраняются в твердых фазах, так что в качестве реагентов или продуктов не задействованы жидкие фазы (H2O, CO2). Твердые реакции чистого переноса могут быть непрерывными или прерывистыми, а также терминальными.
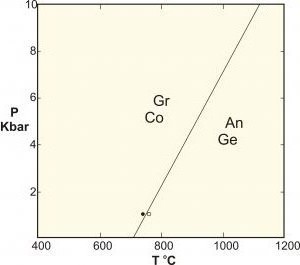
- Полиморфные представляют собой особый тип твердофазной реакции, которая включает фазы идентичного состава. Классическими примерами являются реакции между силикатами алюминия кианит-силлиманит-андалузит, конверсия графита в алмаз при высоком давлении и равновесие карбоната кальция.
Законы равновесия

Фабричное правило Гиббса было предложено Иосией Уиллардом Гиббсом в его знаменитой статье под названием «Равновесие гетерогенных веществ», которая выходила в свет с 1875 по 1878 годы. Оно применяется к нереакционноспособным многокомпонентным гетерогенным системам в термодинамическом равновесии и является заданным равенством:
- F = C-P+2;
- где F – число степеней свободы;
- C – число компонент;
- P - число фаз в термодинамическом равновесии друг с другом.
Число степеней свободы - это количество незанятых интенсивных переменных. Наибольшее количество термодинамических параметров, таких как температура или давление, которые могут варьироваться одновременно и произвольно, не затрагивая друг друга. Примером однокомпонентной системы является система с одним чистым химическим веществом, а двухкомпонентные, такие как смеси воды и этанола, имеют два независимых компонента. Типичными фазовыми переходами (равновесие фаз) являются твердые вещества, жидкости, газы.
Фазовое правило при постоянном давлении
Для приложений в области материаловедения, касающихся фазовых изменений между различными твердыми структурами, часто возникает постоянное давление (например, в одной атмосфере) и игнорируется как степень свободы, поэтому правило становится таким: F = C - P + 1.
Иногда вводят эту формулу под названием «правило с конденсированной фазой», но, как мы знаем, оно неприменимо к данным системам, которые подвержены высоким давлениям (например, в геологии), поскольку последствия этих давлений могут причинить катастрофические последствия.
Может показаться, что фазовое равновесие - просто пустой звук, и мало в каких физических процессах этот момент задействован, но, как мы увидели, без него многие знакомые нам законы не работают, поэтому нужно немножечко ознакомиться с этими уникальными, красочными, хоть и чуть-чуть скучным правилами. Эти знания помогли многим людям. Они научились применять их к себе, например, электрики, зная правила работы с фазами, могут оградить себя от ненужной опасности.


























