Почему атомы могут соединяться друг с другом и образовывать молекулы? Какова причина возможного существования веществ, в состав которых входят атомы совершенно разных химических элементов? Это глобальные вопросы, затрагивающие основополагающие понятия современной физической и химической науки. Ответить на них можно, имея представление об электронном строении атомов и зная характеристики ковалентной связи, являющейся базовой основой для большинства классов соединений. Цель нашей статьи – ознакомиться с механизмами образования различных типов химической связи и особенностями свойств соединений, содержащих их в своих молекулах.
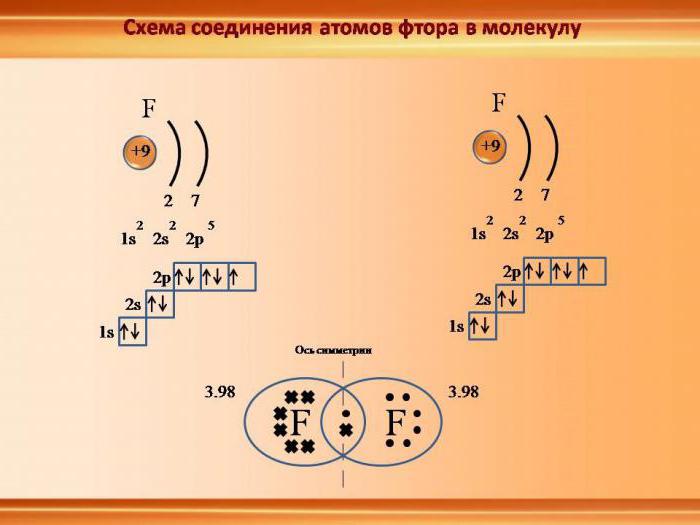
Электронное строение атома
Электронейтральные частицы материи, являющиеся ее структурными элементами, имеют строение, зеркально отражающее устройство Солнечной системы. Как планеты вращаются вокруг центральной звезды – Солнца, так и электроны в атоме движутся вокруг положительно заряженного ядра. Для характеристики ковалентной связи значимыми будут электроны, располагающиеся на последнем энергетическом уровне и наиболее удаленные от ядра. Так как их связь с центром собственного атома минимальна, они способны легко притягиваться ядрами других атомов. Это очень важно для возникновения межатомных взаимодействий, приводящих к образованию молекул. Почему же именно молекулярная форма является основным видом существования материи на нашей планете? Давайте разберемся.
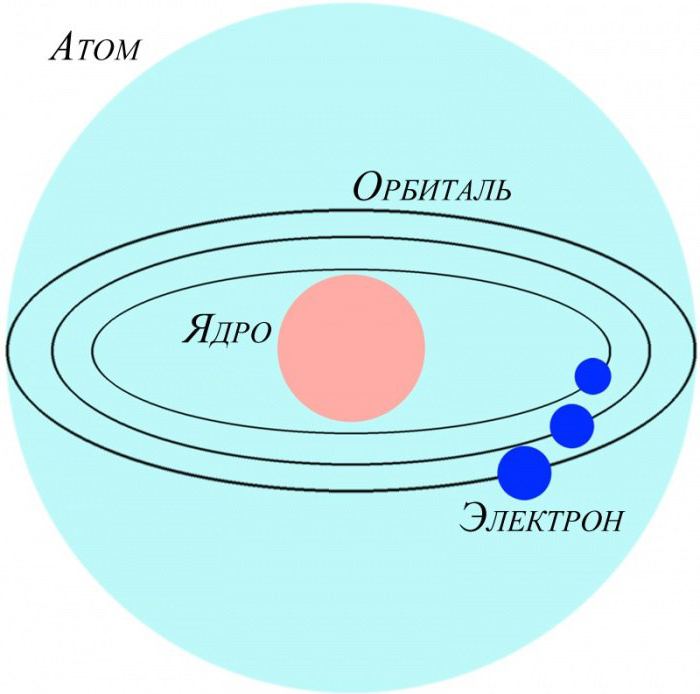
Основное свойство атомов
Способность электронейтральных частиц к взаимодействию, приводящая к выигрышу в энергии, – их важнейшая особенность. Ведь в обычных условиях молекулярное состояние вещества более стойкое, чем атомное. Основные положения современного атомно-молекулярного учения объясняют как принципы образования молекул, так и характеристики ковалентной связи. Напомним, что на внешнем энергетическом уровне атома может находиться от 1 до 8 электронов, в последнем случае слой будет завершенным, а значит, очень устойчивым. Такую структуру внешнего уровня имеют атомы благородных газов: аргона, криптона, ксенона – инертных элементов, завершающих каждый период в системе Д. И. Менделеева. Исключением здесь будет гелий, у которого на последнем уровне находится не 8, а только 2 электрона. Причина проста: в первом периоде - всего два элемента, атомы которых имеют единственный электронный слой. У всех остальных химических элементов на последнем, незавершенном слое располагается от 1 до 7 электронов. В процессе взаимодействия между собой атомы будут стремиться заполниться электронами до октета и восстановить конфигурацию атома инертного элемента. Такое состояние может быть достигнуто двумя путями: потерей собственных или принятием чужих отрицательно заряженных частиц. Эти формы взаимодействия объясняют, как определить, какая связь – ионная или ковалентная - возникнет между вступающими в реакцию атомами.
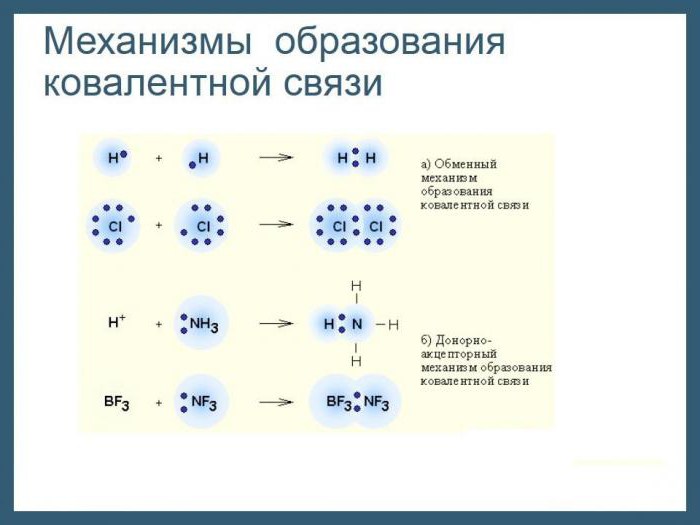
Механизмы образования стойкой электронной конфигурации
Представим, что в реакцию соединения вступают два простых вещества: металлический натрий и газообразный хлор. Образуется вещество класса солей – хлорид натрия. Оно имеет ионный тип химической связи. Почему и как она возникла? Снова обратимся к строению атомов исходных веществ. У натрия на последнем слое находится всего один электрон, слабо связанный с ядром вследствие большого радиуса атома. Энергия ионизации у всех щелочных металлов, к которым относится и натрий, мала. Поэтому электрон внешнего уровня покидает энергетический уровень, притягивается ядром атома хлора и остается в его пространстве. Это создает прецедент перехода атома Cl в форму отрицательно заряженного иона. Теперь мы имеем дело уже не с электронейтральными частицами, а с заряженными катионами натрия и анионами хлора. В соответствии с законами физики между ними возникают силы электростатического притяжения, и соединение образует ионную кристаллическую решетку. Рассмотренный нами механизм формирования ионного типа химической связи поможет более четко выяснить специфику и основные характеристики ковалентной связи.
Общие электронные пары
Если ионная связь возникает между атомами элементов, сильно отличающихся электроотрицательностью, т. е. металлами и неметаллами, то ковалентный тип появляется при взаимодействии атомов как одного и того же, так и разных неметаллических элементов. В первом случае принято говорить о неполярном, а в другом – о полярном виде ковалентной связи. Механизм их образования общий: каждый из атомов частично отдает в общее пользование электроны, которые объединяются попарно. А вот пространственное расположение электронных пар относительно ядер атомов будет неодинаковым. По этому признаку и различают типы ковалентной связи – неполярную и полярную. Наиболее часто в химических соединениях, состоящих из атомов неметаллических элементов, встречаются пары, состоящие из электронов с противоположными спинами, т. е. вращающихся вокруг своих ядер в противоположные стороны. Так как движение отрицательно заряженных частиц в пространстве ведет к образованию электронных облаков, что в конечном счете заканчивается взаимным их перекрыванием. Каковы последствия этого процесса для атомов и к чему он приводит?
Физические свойства ковалентной связи
Оказывается, что между центрами двух взаимодействующих атомов возникает двухэлектронное облако, имеющее большую плотность. Усиливаются электростатические силы притяжения между самим отрицательно заряженным облаком и ядрами атомов. Высвобождается порция энергии и уменьшаются расстояния между атомными центрами. Например, в начале образования молекулы H2 расстояние между ядрами водородных атомов составляет 1,06 А, после перекрывания облаков и образования общей электронной пары – 0,74 А. Примеры ковалентной связи, формирующейся по вышеописанному механизму, можно встретить как среди простых, так и среди сложных неорганических веществ. Ее главная отличительная черта – наличие общих электронных пар. В итоге после возникновения ковалентной связи между атомами, например, водорода каждый из них приобретает электронную конфигурацию инертного гелия, и образовавшаяся молекула имеет устойчивую структуру.
Пространственная форма молекулы
Еще одно очень важное физическое свойство ковалентной связи – это направленность. Он нее зависит пространственная конфигурация молекулы вещества. Например, при перекрывании двух электронов со сферической формой облака вид молекулы линейный (хлороводород или бромоводород). Форма молекул воды, у которой гибридизируются s- и p- облака - угловая, а очень прочные частицы газообразного азота имеют вид пирамиды.
Строение простых веществ – неметаллов
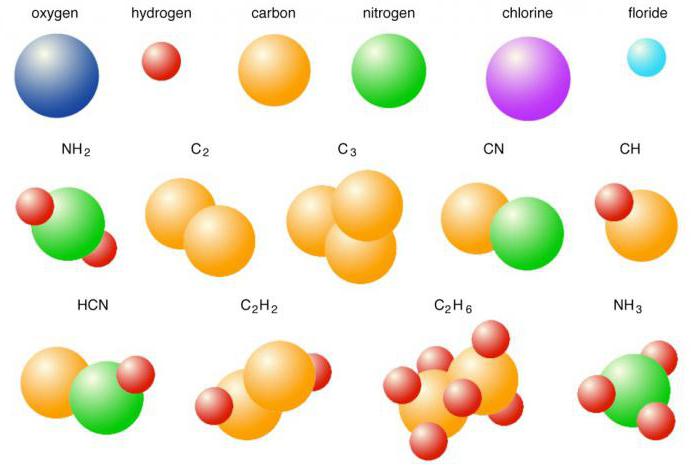
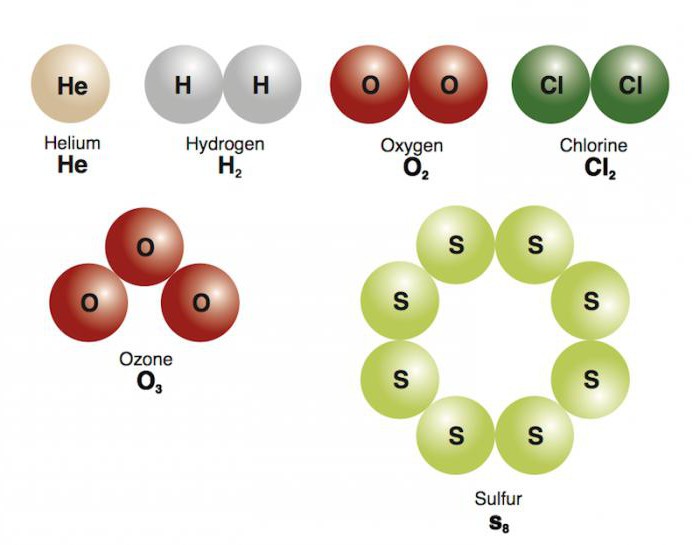
Выяснив, какую связь называют ковалентной, какие признаки она имеет, теперь самое время разобраться с ее разновидностями. Если во взаимодействие между собой вступают атомы одного и того же неметалла – хлора, азота, кислорода, брома и т. д., то формируются соответствующие простые вещества. Их общие электронные пары располагаются на одинаковом расстоянии от центров атомов, не смещаясь. Для соединений с неполярным видом ковалентной связи присущи такие признаки: низкие температуры кипения и плавления, нерастворимость в воде, диэлектрические свойства. Далее мы выясним, для каких веществ характерна ковалентная связь, при которой происходит смещение общих электронных пар.
Электроотрицательность и ее влияние на тип химической связи
Свойство определенного элемента притягивать к себе электроны от атома другого элемента в химии называют электроотрицательностью. Шкалу величин данного параметра, предложенную Л. Полингом, можно встретить во всех учебниках по неорганической и общей химии. Наибольшее его значение – 4,1 эВ - имеет фтор, меньшее – другие активные неметаллы, а наименьший показатель характерен для щелочных металлов. Если между собой реагируют элементы, отличающиеся своей электроотрицательностью, то неизбежно один, более активный, будет притягивать к своему ядру отрицательно заряженные частицы атома более пассивного элемента. Таким образом, физические свойства ковалентной связи напрямую зависят от способности элементов отдавать электроны в общее пользование. Образующиеся при этом общие пары уже не располагаются симметрично относительно ядер, а смещаются в сторону более активного элемента.
Особенности соединений с полярной связью
К веществам, в молекулах которых совместные электронные пары несимметричны относительно ядер атомов, можно отнести галогеноводороды, кислоты, соединения халькогенов с водородом и кислотные оксиды. Это сульфатная и нитратная кислоты, оксиды серы и фосфора, сероводород, и т. д. Например, молекула хлороводорода содержит одну общую электронную пару, образованную неспаренными электронами водорода и хлора. Она смещена ближе к центру атома Cl, являющегося более электроотрицательным элементом. Все вещества с полярной связью в водных растворах диссоциируют на ионы и проводят электрический ток. Соединения, имеющие полярную ковалентную связь, примеры которых мы привели, имеют также более высокие температуры плавления и кипения по сравнению с простыми веществами-неметаллами.
Способы разрыва химических связей
В органической химии реакции замещения предельных углеводородов с галогенами идут по радикальному механизму. Смесь метана и хлора на свету и при обычной температуре реагирует таким образом, что молекулы хлора начинают расщепляться на частицы, несущие неспаренные электроны. Иначе говоря, наблюдается разрушение общей электронной пары и образование очень активных радикалов –Cl. Они способны так воздействовать на молекулы метана, что у тех происходит разрыв ковалентной связи между атомами углерода и водорода. Образуется активная частица –H, а свободная валентность атома углерода принимает радикал хлора, и первым продуктом реакции становится хлорметан. Такой механизм расщепления молекул называется гомолитическим. Если же общая пара электронов полностью переходит во владение к одному из атомов, то говорят о гетеролитическом механизме, характерном для реакций, проходящих в водных растворах. В этом случае полярные молекулы воды будут усиливать скорость разрушения химических связей растворяемого соединения.
Двойные и тройные связи
Подавляющее большинство органических веществ и некоторые неорганические соединения содержат в своих молекулах не одну, а несколько общих электронных пар. Кратность ковалентной связи уменьшает расстояние между атомами и увеличивает стабильность соединений. О них принято говорить как о химически стойких. Например, в молекуле азота имеется три пары электронов, они обозначаются в структурной формуле тремя черточками и обусловливают ее прочность. Простое вещество азот химически инертен и может реагировать с другими соединениями, например с водородом, кислородом или металлами только при нагревании или повышенном давлении, а также в присутствии катализаторов.
Двойные и тройные связи присущи таким классам органических соединений, как непредельные диеновые углеводороды, а также вещества ряда этилена или ацетилена. Кратные связи обусловливают основные химические свойства: реакции присоединения и полимеризации, идущие в местах их разрыва.
В нашей статье мы дали общую характеристику ковалентной связи и рассмотрели ее основные виды.


























