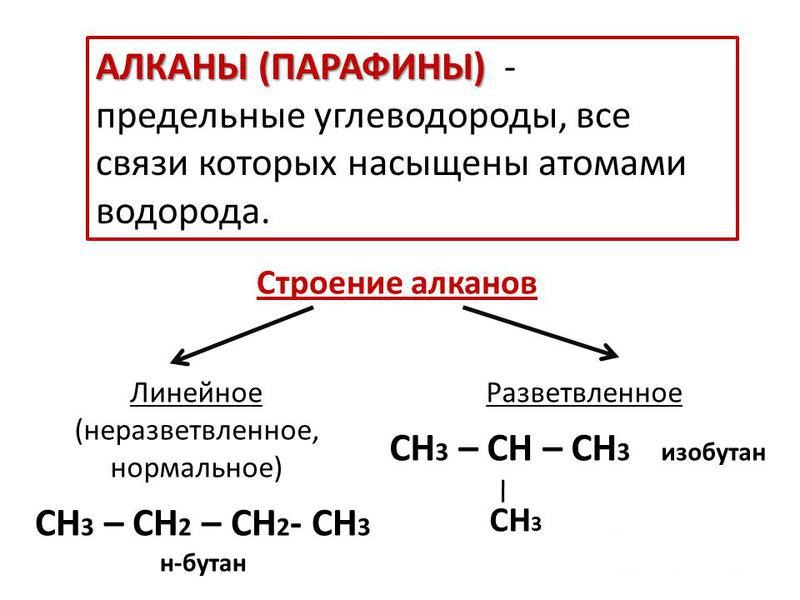
Наиболее простые соединения, изучаемые в курсе органической химии, – это насыщенные углеводороды или парафины, называемые еще алканами. Их качественный состав представлен атомами только двух элементов: углерода и водорода. Молекулы соединений содержат только один тип химической связи – одинарную, или простую. В нашей статье мы изучим строение, а также способы получения и свойства алканов.
Представители ряда и их названия
Первое соединение класса парафинов – это метан. Его молекулярная формула - CH4, она соответствует общей формуле веществ, имеющей следующий вид: CnH2n+2. Первые четыре алкана имеют индивидуальные названия, например, метан, этан. Начиная с пятого соединения, номенклатура построена с использованием греческих числительных. Например, вещество с пятью атомами углерода в составе молекулы C5H12 называется пентаном (от греческого слова "пента" – пять). По рациональной номенклатуре алканы, химические свойства и получение которых мы изучаем, можно представить в форме веществ - производных метана. В его молекуле один или несколько водородных атомов замещены углеводородными радикалами. По систематической номенклатуре следует выбрать самую длинную цепь атомов карбона, которые нумеруют с того конца, к которому ближе расположены радикалы. Затем определяют номер атома углерода, связанного сигма-связью с частицей радикала, и уточняют радикал, добавляя к нему название самого алкана, например, 3-метилбутан.
Получение алканов
Главным и наиболее распространенным источником добычи парафинов являются полезные ископаемые: природный газ и нефть. Следы метана вместе с водородом и азотом можно обнаружить в составе болотного газа. Твердые алканы, содержащие в составе молекулы большое количество атомов углерода, присутствуют в озокерите. Это горный воск, обладающий целым спектром уникальных свойств, залежи которого разрабатываются, например, на территории Западной Украины. Также существует ряд синтетических способов добычи предельных углеводородов, в частности, реакцией восстановления. В промышленности можно выделить несколько методов получения алканов при помощи окислительно-восстановительных реакций, например, идущих между галогеноалкилами и йодистым водородом или амальгамой натрия. Более простым является восстановление алкенов, алкинов или алкадиенов водородом в присутствии никелевого катализатора. Продуктом реакции будет соответствующий парафин. Процесс можно выразить следующим уравнением реакции:
CH2 = CH2 + H2 = H3C-CH3 (этан)
Щелочное плавление солей карбоновых кислот
Если нагревать натриевую соль CH3COONa или другие вещества этого класса, в состав которых входят атомы активных металлов, с гидроксидом натрия или натронной известью, можно получить предельные углеводороды. Первый вид реакции чаще используют в условиях лаборатории, второй применяется для точного анализа строения карбоновой кислоты, входящей в состав соли. Этот метод получения алканов позволяет наблюдать расщепление углеродной цепи реагента и уменьшение в ней количества атомов углерода.
Реакция Вюрца
Вещества, являющиеся производными парафинов, в составе которых произошло замещение атомов водорода на частицы хлора, брома или йода, могут вступать во взаимодействие с мелкодисперсным металлическим натрием. Уравнение реакции в общем виде будет таким:
2RHal + 2Na → R—R + 2NaHal,
Этот процесс было открыт в 1870 году французским химиком Ф. Вюрцем. Позже П. П. Шарыгин уточнил его механизм, приводящий к получению алкана. Оказалось, что атом галогена вначале замещается металлом. Затем образующееся натрийорганическое вещество взаимодействует с другой молекулой галогеноалкана. Данная реакция нашла применение в технологии синтеза высших парафинов.

Свойства предельных углеводородов
Физическая характеристика каждого класса органических соединений определяется свойствами, которые изменяются закономерно, и зависит от строения молекул веществ. Так, четыре первых гомолога алканов, реакции получения которых мы рассмотрели ранее, являются газами. Парафины, содержащие в своем составе от 5 до 14 атомов углерода, существуют в жидкой фазе, остальные же алканы являются твердыми соединениями. Газообразные и твердые вещества не имеют запаха, жидкие парафины пахнут керосином или бензином. К важнейшим химическим свойствам веществ относится, например, жесткое окисление – горение, в результате которого выделяется большое количество теплоты:
СН4 + 2О2 = СО2 + 2Н2О
Напомним, что метан является главным компонентом основного топлива – природного газа.
Реакции замещения
Галогенирование, проходящее по свободнорадикальному механизму, – еще одна особенность алканов. Оно относится к реакциям замещения и приводит к образованию соединений - галогенопроизводных парафинов:
C5H12+Cl2 = HCl + C5H11Cl (хлорпентан).
Нитрование – это взаимодействие алканов с разбавленной нитратной кислотой в присутствии катализатора и под давлением, открытое в 1889 году Н. М. Коноваловым. Нитросоединения парафинов имеют широкий спектр применения в качестве сырья для получения ракетного топлива, взрывчатки, а также для добычи карбоновых кислот и аминов.

Окисление высших членов гомологического ряда алканов в присутствии катализатора приводит к получению спиртов и карбоновых кислот, применяемых для синтеза пластификаторов, используемых для производства пластмасс и моющих средств.
В нашей статье мы рассмотрели свойства предельных углеводородов и изучили способы их получения.



























