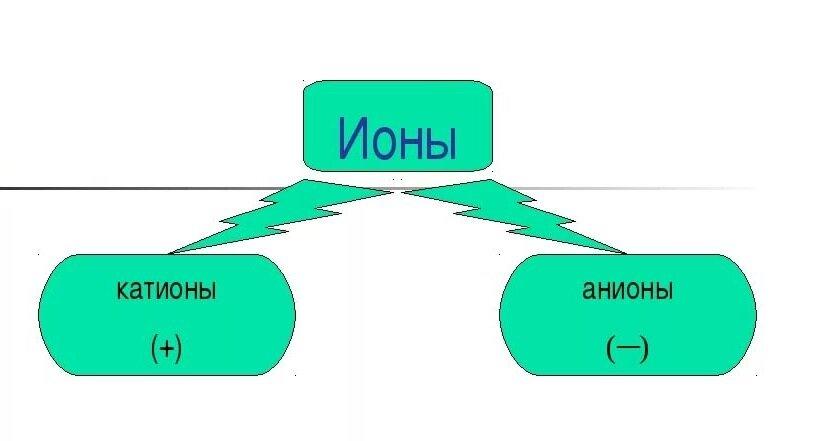
Анионы - это отрицательно заряженные ионы, играющие важную роль в химии. Они противоположны по заряду катионам, которые несут положительный заряд. В данной статье мы разберем, что представляют собой анионы, какие бывают их виды, как они образуются и для чего нужны.
Определение анионов
Анионами называются отрицательно заряженные ионы, образующиеся при диссоциации или ионизации веществ. Как правило, анионами становятся неметаллы и их соединения при растворении или плавлении. Например, хлорид-ион Cl-, сульфат-ион SO42-, нитрат-ион NO 3-.
Противоположностью анионов являются катионы - положительно заряженные ионы. Анионы и катионы совместно образуют ионные соединения - соли. Таким образом, анионы - неотъемлемый компонент любой соли в химии.
Виды анионов
Различают несколько видов анионов:
- Простые анионы - состоят только из одного элемента, например Cl-, Br-, I-;
- Сложные анионы - состоят из двух и более элементов, например SO42-, CO32-;
- Органические анионы - содержат углерод, например CH3COO-;
- Переходные анионы - могут как отдавать, так и принимать электроны, меняя заряд, например Fe2+/Fe3+.
Анион: его свойства
Анионы обладают рядом важных свойств:
- Отрицательный заряд. В отличие от электронейтральных атомов и молекул, анионы несут отрицательный заряд;
- Способность к ионной связи. Анионы могут образовывать ионные соединения (соли) с катионами;
- Растворимость в воде. Большинство анионов хорошо растворяются в водных растворах, образуя ионные гидраты;
- Химическая активность. Анионы легко вступают в реакции с катионами и другими веществами.
Таким образом, наличие заряда определяет уникальные химические свойства анионов, отличающие их от нейтральных частиц.
Молы катионов и анионов: количественные соотношения
Для описания количественных соотношений ионов в растворах используется понятие моль. 1 моль любого вещества содержит 6,02*10^23 частиц (постоянная Авогадро).
В ионных соединениях и растворах катионы и анионы - это пары ионов, электрические заряды и количество молей которых сбалансированы. Например:
- В 1 моле хлорида натрия NaCl содержится 1 моль Na+ катионов и 1 моль Cl- анионов;
- В 1 моле сульфата магния MgSO4 - 1 моль Mg2+ и 1 моль SO42-.
Такое количественное соответствие необходимо для электронейтральности соединения.
Качественные реакции на анионы
Для обнаружения анионов в растворе используются качественные реакции. Они основаны на характерных визуально наблюдаемых изменениях при взаимодействии анионов с определенными реагентами.
Например:
- Хлорид-ион образует белый осадок хлорида серебра с раствором AgNO 3;
- Сульфат-ион дает белый осадок с раствором BaCl2;
- Карбонат-ион вскипает при взаимодействии с кислотами.
Такие реакции позволяют обнаружить присутствие тех или иных анионов в анализируемом веществе.
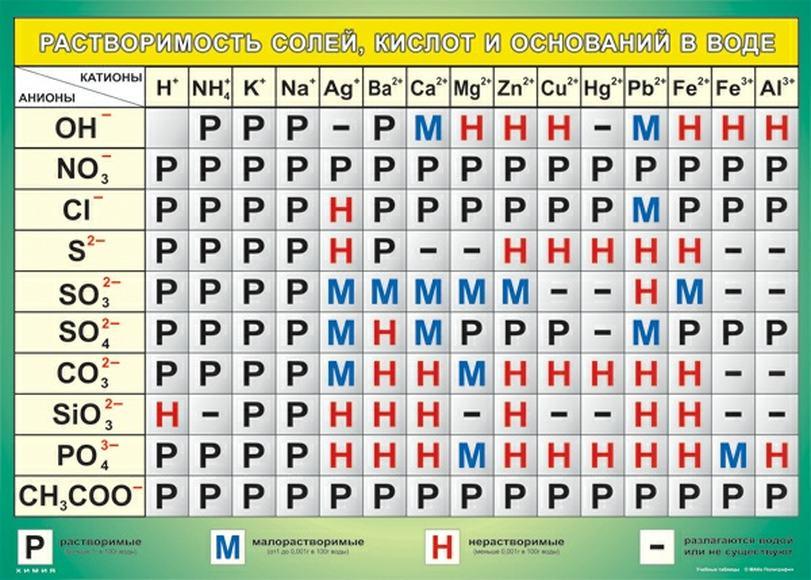
Таблица анионов: классификация по видам
Существует классификация наиболее распространенных анионов в виде таблицы, которая группирует их по различным признакам:
| Тип аниона | Примеры |
| Галогениды | Cl−, Br−, I− |
| Оксиды | O2−, S2− |
| Гидроксиды | OH− |
| Сульфиды | S2− |
Такая классификация удобна для систематизации знаний по неорганической химии.
Анионы солей: роль в образовании солей
Как мы уже выяснили, анионы наряду с катионами являются обязательной составляющей любой соли в химии. Анионы определяют многие свойства конечной соли.
Например, соляная кислота обозначается HCl - она содержит ион водорода и хлорид-ион. При взаимодействии с гидроксидом натрия NaOH образуется хлорид натрия (поваренная соль) NaCl, в котором уже содержится ион Na+ и анион Cl−.
Аналогично, серная кислота H2SO4 при реакции с NaOH образует сульфат натрия Na2SO4. То есть анион SO42− переходит в конечную соль из исходной кислоты.
Так происходит при получении любых солей - катионы и анионы перегруппировываются с образованием новых солей, но сами ионы при этом сохраняются.
Отрицательно заряженный ион: причины возникновения
Возникновение отрицательного заряда у ионов связано с электронным строением атомов химических элементов и закономерностями химических реакций.
Анионы образуются элементами, принимающими электроны на внешний электронный слой для достижения электронной конфигурации ближайшего инертного газа. Принятые электроны и формируют отрицательный заряд частицы.
Например, ион Cl- имеет электронную конфигурацию аргона и завершенный внешний слой из 8 электронов. Подобно формируются ионы O2-, S2-, N3- и многие другие.
Кроме того, отрицательный заряд могут приобретать комплексные ионы, где центральный атом окружен избыточным числом электронных пар лигандов.
Как определить отрицательно заряженный ион
Для определения отрицательно заряженного иона используются:
- Теоретический расчет по электронной конфигурации элементов;
- Экспериментальное определение подвижности ионов в электрическом поле;
- Обнаружение характерных качественных реакций.
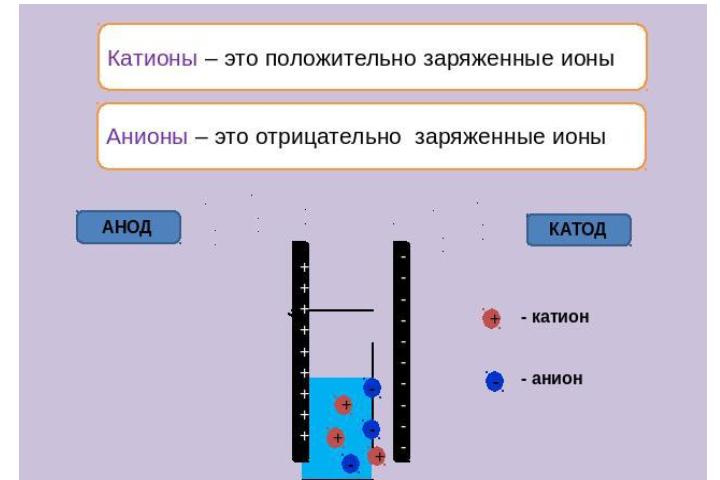
Если частица движется к положительно заряженному электроду или дает специфичные реакции с катионами металлов, то это однозначно указывает на анион.
Роль анионов в живых организмах
Анион - это не только абстрактное понятие неорганической химии. Анионы играют важнейшую роль в биохимических процессах живых организмов.
Так, хлорид-ион Cl- поддерживает осмотическое давление, электролитный баланс крови и участвует в передаче нервных импульсов. Фосфат-ион PO43- входит в состав ДНК и РНК, формируя их химическую основу. Гидрокарбонат-ион HCO3- регулирует pH крови, поддерживая ее слабощелочной характер.
Что представляют собой комплексные анионы
Помимо простых анионов, существуют сложные частицы - комплексные анионы. Они также несут отрицательный заряд, но имеют более сложное строение.
Комплексный анион состоит из центрального атома, как правило переходного металла, и окружающих его лигандов. Лиганды присоединены к центральному атомом donor-акцепторными связями, образуя комплекс.
Ярким примером комплексного аниона является гексацианоферрат-ион [Fe(CN)6]3-, в котором Fe3+ окружен 6 цианид-ионами C≡N-. Важнейшие комплексные анионы - это анионы витаминов и ферментов.
Анионы как лекарственные препараты
Некоторые анионы и их производные широко используются в медицинских целях.
Так, ион йода I- входит в состав йодидов калия и натрия, которые назначают при заболеваниях щитовидной железы. Нитрат-ион NO 3- является основой для нитроглицерина, обладающего сосудорасширяющим действием. Анионы диклофенака, индометацина и мефенамовой кислоты относятся к нестероидным противовоспалительным средствам.
Анионы как аналитические реагенты
Благодаря характерным химическим свойствам, многие анионы нашли широкое применение в аналитической химии в качестве реагентов.
Тиосульфат натрия Na2S2O3 используется для определения концентраций окислителей йодометрическим методом. Роданид-ион SCN- служит для обнаружения ионов Fe3+. Оксалат C2O42– и фосфат PO43– ионы позволяют оценить концентрацию ионов Ca2+ и магния при комплексометрическом титровании.
Анионы как загрязнители окружающей среды
Некоторые анионы, попадая в избыточных концентрациях в почву, воду и воздух становятся опасными загрязнителями окружающей среды.
В частности, выбросы оксидов серы и азота приводят к образованию сульфат-, нитрат- и нитрит-ионов, которые влияют на кислотно-основной баланс почвы. Избыточный хлорид натрия NaCl и другие соли засолоняют почву. Накопление тяжелых металлов происходит именно в ионной форме, например ионов ртути, свинца, кадмия.
Перспективы применения анионов
Учитывая уникальные физико-химические свойства анионов, перспективным представляется их использование в передовых областях науки и техники.
В частности, исследуются высокопроводящие анионные полимеры для создания легких и емких аккумуляторов. Разрабатываются анионообменные мембраны для опреснения воды методом обратного осмоса. Изучается возможность применения наночастиц с поверхностными анионами в катализе и биомедицинских целях.
Анионы в космосе
Анионы, наряду с другими ионами и нейтральными частицами, обнаружены за пределами Земли в межзвездном пространстве. Это относится, прежде всего, к простейшим ионам - H−, C−, O−, OH−.
Предполагается, что анионы играют определенную роль в физико-химических процессах, протекающих в газопылевых туманностях и плотных молекулярных облаках Вселенной. Возможно, анионы также присутствуют в атмосферах планет-гигантов.
Происхождение анионов во Вселенной
Первые анионы могли возникнуть еще на заре формирования Вселенной в результате ионизации водорода и гелия под действием излучений и ударных волн.
В дальнейшем, в недрах звезд при термоядерном синтезе сформировались более сложные анионы химических элементов. Рассеиваясь при взрывах сверхновых, анионы стали частью межзвездной пыли, газа и льда.
Поиск анионов на других планетах
Анионы, вероятно, присутствуют на планетах Солнечной системы со схожими земным условиями. В частности, ионы хлора и серы обнаружены в атмосфере и на поверхности Венеры, а также в облаках Венеры и Марса.
Перспективной задачей является поиск следов анионов на спутниках газовых гигантов, где возможно существование подповерхностных водных океанов. Также анионы могут присутствовать в атмосферах экзопланет в обитаемых зонах других звезд.
Анионы в искусстве и культуре
Несмотря на кажущуюся абстрактность, образы анионов проникают и в область искусства.
Яркие вихри синего цвета в картине Ван Гога напоминают движение электронов в ионе. Завораживающие формы минералов отражают симметрию расположения анионов и катионов в кристаллических решетках. Анионы вдохновляют художников и скульпторов на создание новых произведений!


























