Первичная структура белка - это код, заложенный природой, который определяет все остальные его свойства. Понимание принципов формирования этого кода позволит лучше контролировать функции белковых молекул. Давайте разберемся, как именно первичная структура белка предопределяет его роль в организме.
Определение первичной структуры белка
Первичная структура белка представляет собой линейную последовательность аминокислотных остатков, соединенных между собой пептидными связями. Именно эта последовательность кодируется генетической информацией и определяется нуклеотидной последовательностью гена, кодирующего данный белок.
Первичная структура белка является определяющим фактором его химической структуры (химической формулы). Для любой молекулы белков характерна определенная последовательность аминокислот. Она, в свою очередь, определяется последовательностью в генетической структуре.
Таким образом, именно первичная структура, заложенная в генетическом коде, определяет все последующие уровни пространственной организации белка и в конечном итоге его биологические функции. Даже небольшие изменения в аминокислотной последовательности могут приводить к значительным функциональным изменениям.
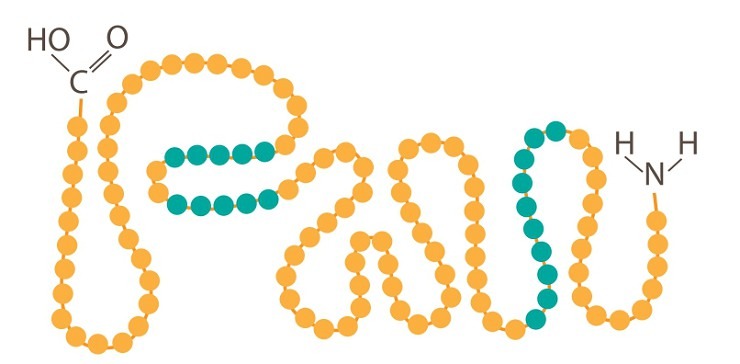
Методы определения первичной структуры
Существует несколько основных методов, позволяющих установить первичную структуру белка, то есть определить последовательность аминокислот в полипептидной цепи:
- Химический гидролиз белка с последующим определением аминокислотного состава
- Масс-спектрометрия
- Рентгеноструктурный анализ
- ЯМР-спектроскопия
- Секвенирование нуклеиновых кислот (определение нуклеотидной последовательности кодирующего белок гена)
Первоначально первичную структуру устанавливали путем полного химического гидролиза белка с последующим анализом аминокислотного состава. В настоящее время чаще применяются более современные физико-химические методы, такие как масс-спектрометрия и ЯМР.
В настоящее время определение последовательности аминокислот является автоматизированным процессом. Первичная структура белка уже известна для более чем сотни тысяч белков.
Однако наиболее распространенным подходом стало определение нуклеотидной последовательности гена, кодирующего данный белок. Зная генетический код, можно однозначно вывести соответствующую аминокислотную последовательность.
Факторы, влияющие на формирование структуры
Помимо самой аминокислотной последовательности, на формирование пространственной структуры белка оказывают влияние и другие факторы:
- Характеристики аминокислот (размер, заряд, гидрофобность R-групп)
- Особенности пептидных связей
- Взаимодействия между R-группами аминокислотных остатков
- Влияние окружающей среды (pH, температура, ионная сила)
Так, например, за счет особенностей пептидных связей формируется вторичная структура, представляющая собой регулярные спирали и изгибы полипептидной цепи. А гидрофобные взаимодействия между R-группами приводят к образованию компактного гидрофобного ядра белка.
Таким образом, первичная структура задает общие рамки пространственной организации белка, но конечный результат определяется совокупным действием многих факторов.
Связь первичной структуры и функций белка
Поскольку именно первичная структура задает пространственную конфигурацию белка, от нее напрямую зависят все функции, выполняемые данным белком в организме.
- Активность ферментов определяется расположением аминокислот в активном центре, что зависит от первичной структуры.
- Транспортные белки (например, гемоглобин) также функционируют благодаря специфической пространственной структуре, заданной последовательностью аминокислот.
- Подвижность и сократительная способность белков цитоскелета и мышечной ткани определяются особенностями их первичной структуры.
- Свойства антител иммунной системы, распознающих чужеродные агенты, зависят от аминокислотных последовательностей вариабельных участков.
- Гормоны и другие регуляторные белки могут связываться со своими рецепторами и запускать определенные каскады реакций только благодаря своей пространственной структуре, которая определяется первичной последовательностью.
Таким образом, можно утверждать, что первичная структура белка определяет все многообразие его биологических функций в организме.
Патологии, связанные с нарушениями структуры
Любые нарушения на уровне первичной структуры белка могут приводить к патологическим изменениям его функций.
К примеру, точечные мутации, затрагивающие замену отдельных аминокислот, зачастую становятся причиной тяжелых наследственных заболеваний. Известно более 3000 таких моногенных болезней.
Ошибки транскрипции и трансляции, приводящие к нарушениям первичной структуры, могут вызывать метаболические и регуляторные сбои.
Нарушение сворачивания белков и образование неразложимых белковых агрегатов лежат в основе болезней Альцгеймера, Паркинсона и других амилоидозов.
Методы воздействия на первичную структуру
Существуют различные методы искусственного воздействия на первичную структуру белка в прикладных и исследовательских целях:
- Химическая модификация (ацетилирование, фосфорилирование, пегилирование)
- Генная инженерия
- Направленная денатурация и ренатурация
Такие методы позволяют получать белки с нужными свойствами, изучать влияние различных факторов на структуру и функции.
Перспективы изучения первичной структуры белков
Дальнейшее изучение принципов формирования первичной структуры белков и ее связи с функциями открывает широкие перспективы:
- Создание новых лекарств путем модификации белков
- Получение биокатализаторов с улучшенными свойствами
- Анализ эволюции организмов на молекулярном уровне
- Разработка методов персонализированной медицины
Понимание фундаментальных основ структурной организации белков открывает огромные возможности полученных знаний.
Изучение принципов формирования первичной структуры белков позволит в будущем:
- Конструировать белки и ферменты с необходимыми свойствами для нужд промышленности, сельского хозяйства, медицины;
- Проводить точечную коррекцию структуры белков с целью лечения наследственных заболеваний;
- Создавать высокоспецифичные диагностические тест-системы на основе анализа первичной структуры;
- Получать новые биологически активные соединения путем модификации уже известных белков.
Благодаря углубленному изучению фундаментальных основ структурной организации белков человечество получит мощный инструмент воздействия на живые системы, который может быть использован на благо прогресса.
Исследование гомологичных белков
Изучение первичных структур гомологичных белков у разных биологических видов позволяет получить данные об эволюционных взаимосвязях между организмами.
Например, сравнение аминокислотных последовательностей цитохрома C у различных видов выявляет степень их родства. Чем меньше различий в первичной структуре, тем ближе расположены виды на эволюционном древе.
Цитохромы С лошади и дрожжей различаются по 48 аминокислотным остаткам, куры и утки — по 2, а у курицы и индейки цитохромы идентичны.
Генетический полиморфизм белков
Существует естественная изменчивость первичной структуры одних и тех же белков у разных представителей одного вида. Этот генетический полиморфизм объясняется наличием различных аллельных вариантов генов.
К примеру, известно более 300 аллельных вариантов гена, кодирующего белок гемоглобин человека. Некоторые из них приводят к патологическим изменениям структуры и функций гемоглобина.
Прикладное значение белковой инженерии
Целенаправленное конструирование белков с заданными свойствами, основанное на глубоком понимании принципов формирования первичной структуры, открывает огромные возможности в самых различных областях:
- Создание новых лекарств и диагностических средств;
- Получение устойчивых ферментов для промышленности;
- Разработка биосенсоров для экологического мониторинга;
- Повышение продуктивности сельскохозяйственных культур с помощью генной инженерии.
Посттрансляционные модификации
После синтеза полипептидной цепи в ней могут происходить дальнейшие химические превращения, приводящие к модификации первичной структуры.
Такие посттрансляционные модификации включают фосфорилирование, гидроксилирование, ацетилирование, гликозилирование, дезаминирование остатков аминокислот.
Благодаря этим процессам один и тот же белок может существовать в различных изоформах, отличающихся биологической активностью.


























