Начиная от периода античности и до средины 18-го века в науке господствовали представления о том, что атом – это частица материи, которую нельзя разделить. Английский ученый, а также и естествоиспытатель Д. Дальтон дал определение атома как наименьшей составной части химического элемента. М. В. Ломоносов в своем атомно-молекулярном учении смог дать определение атома и молекулы. Он был уверен в том, что молекулы, которые он называл «корпускулами», состоят из «элементов» - атомов - и находятся в постоянном движении.
Д. И. Менделеев считал, что эта субъединица веществ, составляющих материальный мир, сохраняет все свои свойства только в случае, если она не подвергается разделению. В данной статье мы дадим определение атома как объекта микромира и изучим его свойства.
Предпосылки создания теории строения атома
В 19 веке общепризнанным считалось утверждение о неделимости атома. Большинство ученых считали, что частицы одного химического элемента ни при каких условиях не могут превратиться в атомы другого элемента. Эти представления служили основой, на которой базировалось определение атома до 1932 года. В конце 19 столетия в науке были сделаны фундаментальные открытия, которые изменили эту точку зрения. Прежде всего в 1897 году английским физиком Д. Ж. Томсоном был открыт электрон. Этот факт в корне менял представления ученых о неделимости составной части химического элемента.
Как доказать, что атом сложно устроен
Еще до открытия электрона ученые единодушно сходились во мнении о том, что атомы не имеют зарядов. Потом было установлено, что электроны легко выделяются из какого угодно химического элемента. Их можно обнаружить в пламени, они являются переносчиками электрического тока, их выделяют вещества во время рентгеновского излучения.

Но если электроны входят в состав всех без исключения атомов и заряжены отрицательно, значит, в атоме есть еще какие-то частицы, которые обязательно имеют положительный заряд, в противном случае атомы не были бы электронейтральными. Помочь разгадать строение атома помогло такое физическое явление, как радиоактивность. Оно дало правильно определение атома в физике, а затем и в химии.
Невидимые лучи
Французским физиком А. Беккерелем было впервые описано явление испускания атомами некоторых химических элементов, визуально невидимых лучей. Они ионизируют воздух, проходят через вещества, вызывают почернение фотопластинок. Позже супруги Кюри и Э. Резерфорд установили, что радиоактивные вещества превращаются в атомы других химических элементов (например, уран – в нептуний).
Радиоактивное излучение неоднородно по составу: альфа-частицы, бета-частицы, гамма-лучи. Таким образом, явление радиоактивности подтвердило, что частицы элементов таблицы Менделеева имеют сложное строение. Этот факт послужил причиной изменений, внесенных в определение атома. Из каких частиц состоит атом, если учитывать полученные Резерфордом новые научные факты? Ответом на этот вопрос стала предложенная ученым ядерная модель атома, согласно которой вокруг положительно-заряженного ядра вращаются электроны.
Противоречия модели Резерфорда
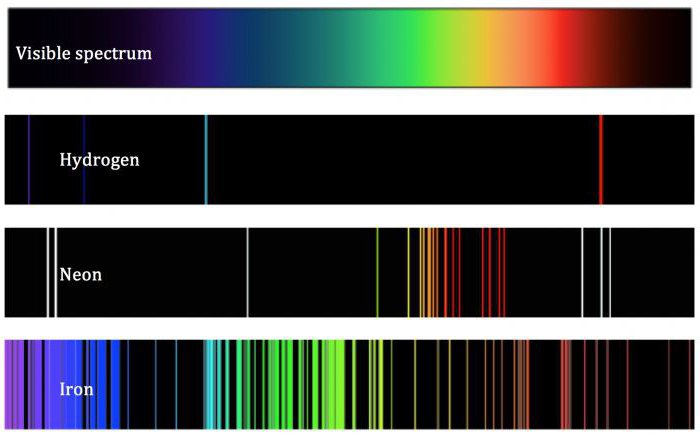
Теория ученого, несмотря на ее выдающийся характер, не смогла объективно дать определение атома. Её выводы шли вразрез с фундаментальными законами термодинамики, согласно которым все электроны, вращающиеся вокруг ядра, теряют свою энергию и, как бы то ни было, рано или поздно должны упасть на него. Атом в этом случае разрушается. Этого на самом деле не происходит, так как химические элементы и частицы, из которых они состоят, существуют в природе очень долго. Необъяснимо такое определение атома, базирующиеся на теории Резерфорда, равно как и явление, возникающее при пропускании раскаленных простых веществ через дифракционную решетку. Ведь образующиеся при этом атомные спектры имеют линейную форму. Это вступало в противоречие с резерфордовской моделью атома, согласно которой спектры должны были бы быть сплошными. Согласно представлениям квантовой механики, в настоящее время электроны характеризуются в ядре не как точечные объекты, а как имеющие вид электронного облака.

Наибольшая его плотность в определенном локусе пространства вокруг ядра и считается местоположением частицы в данный момент времени. Также было выяснено, что в атоме электроны расположены послойно. Количество слоев можно определить, зная номер периода, в котором находится элемент в периодической системе Д. И. Менделеева. Например, атом фосфора содержит 15 электроном и имеет 3 энергетических уровня. Показатель, определяющий количество энергетических уровней, называют главным квантовым числом.
Экспериментально было установлено, что электроны энергетического уровня, расположенного ближе всех к ядру, имеют наименьшую энергию. Каждая энергетическая оболочка делится на подуровни, а они, в свою очередь, на орбитали. Электроны, расположенные на различных орбиталях, имеют равную форму облака (s, p, d, f).
Исходя из вышесказанного следует, что форма электронного облака не может быть произвольной. Она строго определена согласно орбитального квантового числа. Добавим еще и то, что состояние электрона в макрочастице определяется еще двумя значениями – магнитным и спиновым квантовыми числами. Первое базируется на уравнении Шредингера и характеризует пространственную ориентацию электронного облака исходя из трехмерности нашего мира. Второй показатель – спиновое число, по нему определяют вращение электрона вокруг своей оси по или против часовой стрелки.
Открытие нейтрона
Благодаря работам Д. Чедвика, проведенным им в 1932 году, было дано новое определение атома в химии и физике. В своих опытах ученый доказал, что при расщеплении полония возникает излучение, вызванное частицами, не имеющими заряда, с массой 1,008665. Новая элементарная частица была названа нейтроном. Её открытие и изучение её свойств позволило советским ученым В. Гапону и Д. Иваненко создать новую теорию строения атомного ядра, содержащего протоны и нейтроны.
Согласно новой теории, определение атома вещества имело следующий вид: это структурная единица химического элемента, состоящая из ядра, содержащего протоны и нейтроны и электронов, движущихся вокруг него. Число положительных частиц в ядре всегда равно порядковому номеру химического элемента в периодической системе.
В дальнейшем профессор А. Жданов в своих опытах подтвердил, что под влиянием жесткого космического излучения атомные ядра расщепляются на протоны и нейтроны. Кроме этого, было доказано, что силы, удерживающие эти элементарные частицы в ядре, чрезвычайно энергоемкие. Они действуют на очень коротких расстояниях (порядка 10-23 см) и называются ядерными. Как было сказано ранее, еще М. В. Ломоносов смог дать определение атома и молекулы исходя из известных ему научных фактов.

В настоящее время общепризнанной считают следующую модель: атом состоит из ядра и электронов, движущихся вокруг него по строго определенным траекториям – орбиталям. Электроны одновременно проявляют свойства и частицы, и волны, то есть, имеют дуальную природу. В ядре атома сосредоточена практически вся его масса. Она состоит из протонов и нейтронов, связанных ядерными силами.
Можно ли взвесить атом
Оказывается, каждый атом имеет массу. Например, у гидрогена она равна 1,67х10-24 г. Даже трудно представить насколько мала эта величина. Чтобы найти вес такого объекта, используют не весы, а осциллятор, представляющий собой углеродную нанотрубку. Для расчета веса атома и молекулы более удобной величиной является относительная масса. Она показывает, во сколько раз вес молекулы или атома больше чем 1/12 часть атома карбона, которая составляет 1,66х10-27 кг. Относительные атомные массы указаны в периодической системе химических элементов, и они не имеют размерности.
Ученые хорошо знают, что атомная масса химического элемента – это средняя величина массовых чисел всех его изотопов. Оказывается, в природе единицы одного химического элемента могут иметь различные массы. При этом заряды ядер таких структурных частиц одинаковы.
Учеными установлено, что изотопы различаются между собой количеством нейтронов в ядре, а заряд ядер у них одинаков. Например, у атома хлора, имеющего массу 35 содержится 18 нейтронов и 17 протонов, а с массой 37 – 20 нейтронов и 17 протонов. Многие химические элементы представляют собой смеси изотопов. Например, такие простые вещества, как калий, аргон, кислород содержат в своем составе атомы, представляющие 3 разных изотопа.
Определение атомарности
Оно имеет несколько трактовок. Рассмотрим, что понимают под этим термином в химии. Если атомы какого-либо химического элемента способны хотя бы кратковременно существовать обособленно, не стремясь к образованию более сложной частицы – молекулы, то говорят, что такие вещества имеют атомарное строение. Например, многостадийная реакция хлорирования метана. Она широко применяется в химии органического синтеза для получения важнейших галогеносодержащих производных: дихлорметана, четыреххлористого углерода. В ней происходит расщепление молекул хлора на атомы, обладающие высокой реакционной способностью. Они разрушают сигма-связи в молекуле метана, обеспечивая цепную реакцию замещения.
Еще один пример химического процесса, имеющего большое значение в промышленности – использование пероксида водорода в качестве дезинфицирующего и отбеливающего средства. Определение атомарного кислорода, как продукта расщепления перекиси водорода, происходит как в живых клетках (под действием фермента каталазы), так и в лабораторных условиях. Атомарный кислород качественно определяют по его высоким антиоксидантным свойствам, а также по способности разрушать патогенные агенты: бактерии, грибы и их споры.

Как устроена атомная оболочка
Нами было уже выяснено ранее, что структурная единица химического элемента имеет сложное строение. Вокруг положительно-заряженного ядра вращаются отрицательные частицы электроны. Лауреат Нобелевской премии Нильс Бор, основываясь на квантовой теории света, создал свое учение, в котором характеристика и определение атома имеют следующий вид: электроны двигаются вокруг ядра только по определенным стационарным траекториям, при этом не излучают энергию. Учение Бора доказало, что частицы микромира, к которым относятся атомы и молекулы, не подчиняются законам, справедливым для больших тел – объектов макрокосмоса.
Строение электронных оболочек макрочастиц было изучено в работах по квантовой физике таких ученых, как Хунд, Паули, Клечковский. Так стало известно, что электроны делают вращательные движения вокруг ядра не хаотично, а по определенным стационарным траекториям. Паули установил, что в пределах одного энергетического уровня на каждой из его орбиталей s, p, d, f в электронных ячейках может находиться не более двух отрицательно заряженных частиц с противоположным значением спина + ½ и – ½.
Правило Хунда объяснило, как правильно заполняются электронами орбитали с одинаковым уровнем энергии.
Правило Клечковского, называемое еще правилом n+l, объяснило, как заполняются орбитали многоэлектронных атомов (элементов 5, 6, 7 периодов). Все вышеперечисленные закономерности послужили теоретическим обоснованием системы химических элементов, созданной Дмитрием Менделеевым.
Степень окисления
Она является фундаментальным понятием в химии и характеризует состояние атома в молекуле. Современное определение степени окисления атомов звучит следующим образом: это условный заряд атома в молекуле, который рассчитывают исходя из представлений, что молекула имеет только ионный состав.
Степень окисления может выражаться целым или дробным числом, с положительным, отрицательным или нулевым значениями. Чаще всего атомы химических элементов имеют несколько степеней окисления. Например, у азота это -3, -2, 0, +1, +2, +3, +4, +5. А вот такой химический элемент, как фтор, во всех своих соединениях имеет только одну степень окисления, равную -1. Если он представлен простым веществом, то его степень окисления равна нулю. Этой химической величиной удобно пользоваться для классификации веществ и для описания их свойств. Чаще всего степенью окисления атома пользуются в химии при составлении уравнений окислительно-восстановительных реакций.
Свойства атомов
Благодаря открытиям квантовой физики, современное определение атома, базирующееся на теории Д. Иваненко и Е. Гапона, дополняется следующими научными фактами. Строение ядра атома не изменяется во время химических реакций. Изменению подвергаются только стационарные электронные орбитали. Их строением можно объяснить очень много физических и химических свойств веществ. Если электрон покидает стационарную орбиту и переходит на орбиталь с более высоким показателем энергии, такой атом называется возбужденным.

Нужно отметить, что электроны не могут длительное время находиться на таких несвойственных им орбиталях. Возвращаясь на свою стационарную орбиту, электрон излучает квант энергии. Изучение таких характеристик структурных единиц химических элементов, как сродство к электрону, электроотрицательность, энергия ионизации, позволило ученым не только дать определение атома, как важнейшей частице микромира, но также позволило им объяснить способность атомов образовывать стойкое и энергетически более выгодное молекулярное состояние материи, возможное вследствие создания различных типов устойчивой химической связи : ионной, ковалентно-полярной и неполярной, донорно-акцепторной (как разновидности ковалентной связи) и металлической. Последняя обуславливает важнейшие физические и химические свойства всех металлов.
Экспериментально установлено, что размер атома может изменяться. Всё будет зависеть от того, в какую молекулу он входит. Благодаря рентгеноструктурному анализу можно рассчитать расстояние между атомами в химическом соединении, а также узнать радиус структурной единицы элемента. Владея закономерностями изменения радиусов атомов, входящих в период или в группу химических элементов, можно спрогнозировать их физические и химические свойства. Например, в периодах с увеличением заряда ядра атомов их радиусы уменьшаются («сжатие атома»), поэтому металлические свойства соединений ослабевают, а неметаллические усиливаются.
Таким образом, знания о строении атома позволяют точно определить физические и химические свойства всех элементов, входящих в периодическую систему Менделеева.


























