Наша статья будет посвящена изучению свойств веществ, являющихся основой феномена жизни на Земле. Белковые молекулы присутствуют в неклеточных формах – вирусах, входят в состав цитоплазмы и органоидов прокариотических и ядерных клеток. Наряду с нуклеиновыми кислотами они образуют вещество наследственности – хроматин и формируют главные компоненты ядра - хромосомы. Сигнальная, строительная, каталитическая, защитная, энергетическая – это перечень биологических функций, которые выполняют белки. Физико-химические свойства белков заключаются в их способности к растворимости, осаждению, высаливанию. Кроме того, они способны денатурировать и являются по своей химической природе амфотерными соединениями. Изучим эти свойства протеинов далее.

Виды белковых мономеров
20 видов α-аминокислот - это структурные единицы белка. Кроме углеводородного радикала, они содержат NH2- аминогруппу и COOH-карбоксильную группу. Функциональные группы определяют кислотные и основные свойства мономеров белка. Поэтому в органической химии соединения этого класса называют амфотерными веществами. Ионы водорода карбоксильной группы внутри молекулы могут отщепляться и связываться с аминогруппами. В результате образуется внутренняя соль. Если в молекуле присутствуют несколько карбоксильных групп, то соединение будет кислым, как, например, глутаминовая или аспарагиновая кислота. Если же преобладают аминогруппы – аминокислоты имеют основный характер (гистидин, лизин, аргинин). При равном количестве функциональных групп раствор пептида имеет нейтральную реакцию. Установлено, что присутствие всех трех видов аминокислот влияет на то, какие признаки будут иметь белки. Физико-химические свойства белков: растворимость, водородный показатель, заряд макромолекулы, определяются по соотношению кислых и основных аминокислот.
Какие факторы влияют на растворимость пептидов
Выясним все необходимые критерии, от которых зависят процессы гидратации или сольватации макромолекул белков. Это: пространственная конфигурация и молекулярная масса, определяемая по количеству аминокислотных остатков. Также учитывается соотношение полярных и неполярных частей – радикалов, находящихся на поверхности белка в третичной структуре и суммарный заряд полипептидной макромолекулы. Все выше названные свойства непосредственно влияют на растворимость белка. Рассмотрим их подробнее.
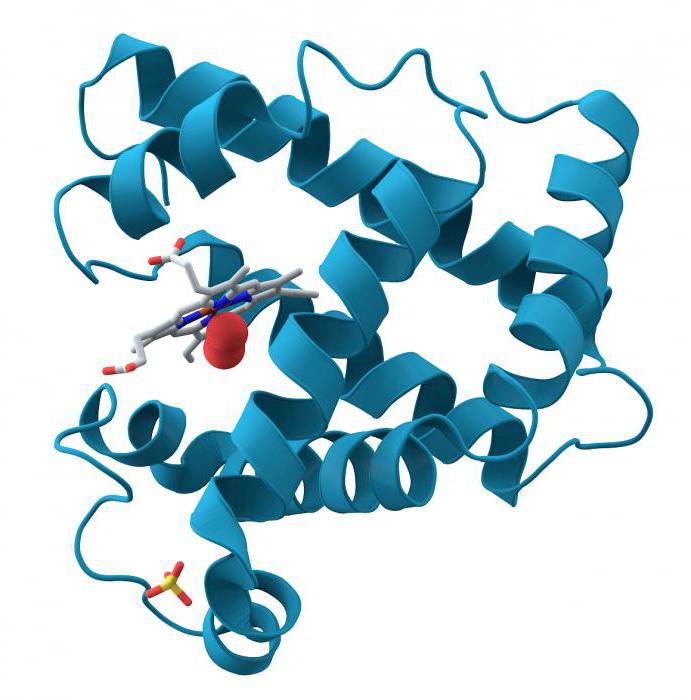
Глобулы и их способность к гидратации
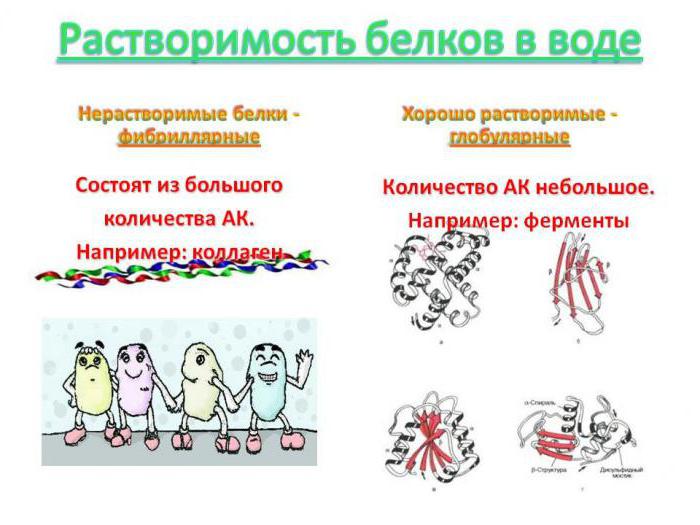
Если внешнее строение пептида имеет шаровидную форму, то принято говорить о его глобулярной структуре. Она стабилизирована водородными и гидрофобными связями, а также силами электростатического притяжения разноименно заряженных частей макромолекулы. Например, гемоглобин, переносящий по крови молекулы кислорода, в четвертичной форме состоит из четырех фрагментов миоглобина, объединенных с помощью гема. Такие белки крови, как альбумины, α – и ϒ -глобулины, легко взаимодействуют с веществами кровяной плазмы. Инсулин – еще один глобулярный пептид, который регулирует уровень глюкозы в крови млекопитающих и человека. Гидрофобные части таких пептидных комплексов находятся в середине компактной структуры, а гидрофильные располагаются на ее поверхности. Это обеспечивает им сохранение нативных свойств в жидкой среде организма и объединяет их в группу водорастворимых белков. Исключение составляют глобулярные протеины, формирующие мозаичное строение мембран клеток человека и животных. Они связаны с гликолипидами и нерастворимы в межклеточной жидкости, что обеспечивает выполнение ими барьерной роли в клетке.
Фибриллярные пептиды
Коллаген и эластин, входящие в состав дермы и обуславливающие ее упругость и эластичность, имеют нитевидную структуру. Они способны растягиваться, изменяя свою пространственную конфигурацию. Фиброин – белок натурального шелка, вырабатывается личинками тутового шелкопряда. Он содержит короткие структурные волокна, состоящие из аминокислот с небольшой массой и длиной молекулы. Это, прежде всего, серин, аланин и глицин. Его полипептидные цепи ориентированы в пространстве в вертикальном и горизонтальном направлении. Вещество относится к структурным полипептидам и имеет слоистую форму. В отличие от глобулярных полипептидов, растворимость белка, состоящего из фибрилл, очень мала, так как гидрофобные радикалы его аминокислот лежат на поверхности макромолекулы и отталкивают полярные частицы растворителя.
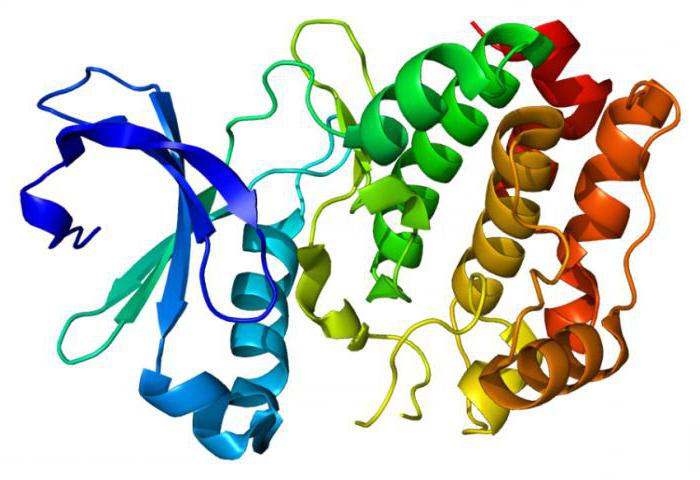
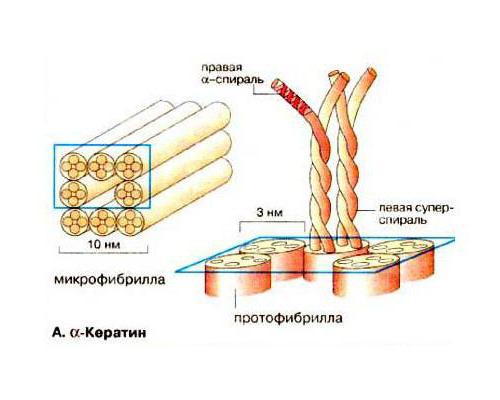
Кератины и особенности их строения
Рассматривая группу структурных белков фибриллярной формы, таких, как фиброин и коллаген, нужно остановиться еще на одной широко распространенной в природе группе пептидов - кератинов. Они служат основой таких частей тела человека и животных, как волосы, ногти, перья, шерсть, копыта и когти. Что такое кератин сточки зрения его биохимического строения? Установлено, что существует два вида пептидов. Первый имеет вид спиральной вторичной структуры (α-кератин) и является основой волос. Другой представлен долее жесткими слоистыми фибриллами – это β-кератин. Его можно обнаружить в твердых частях тела животных: копытах, птичьих клювах, чешуях пресмыкающихся, когтях хищных млекопитающих и птиц. Что такое кератин, исходя из того, что его аминокислоты, например, такие, как валин, фенилаланин, изолейцин, содержат большое количество гидрофобных радикалов? Это нерастворимый в воде и других полярных растворителях белок, выполняющий защитную и структурную функции.
Влияние рН среды на заряд белкового полимера
Ранее мы упоминали о том, что функциональные группы белковых мономеров - аминокислот, определяют их свойства. Добавим теперь, что от них зависит и заряд полимера. Ионогенные радикалы – карбоксильные группы глутаминовой и аспарагиновой кислоты и аминогруппы аргинина и гистидина влияют на общий заряд полимера. Они также ведут себя различно в кислой, нейтральной или щелочной среде раствора. От этих факторов зависит и растворимость белка. Так, при рН<7 раствор содержит избыточную концентрацию протонов водорода, которые угнетают расщепление карбоксила, поэтому общий положительный заряд на молекуле протеина увеличивается.
Накопление катионов в белке возрастает также в случае нейтральной среды раствора и при избытке мономеров аргинина, гистидина и лизина. В щелочной среде происходит увеличение отрицательного заряда полипептидной молекулы, т. к. избыток ионов водорода расходуется на образование молекул воды путем связывания гидроксильных групп.
Факторы, определяющие растворимость белков
Представим ситуацию, при которой количество положительных и отрицательных зарядов на белковой спирали одинаково. Показатель рН среды в этом случае называется изоэлектрической точкой. Общий же заряд самой макромолекулы пептида становится нулевым, а его растворимость в воде или другом полярном растворителе будет минимальной. Положения теории электролитической диссоциации утверждают, что растворимость вещества в полярном растворителе, состоящем из диполей, будет тем выше, чем более поляризованы частицы растворяемого соединения. Они же объясняют и факторы, определяющие растворимость белков: их изоэлектрическую точку и зависимость гидратации или сольватации пептида от суммарного заряда его макромолекулы. Большинство полимеров этого класса содержат избыток групп –COO- и имеют слабокислые свойства. Исключением будут уже упоминавшиеся ранее мембранные белки и пептиды, входящие в состав ядерного вещества наследственности - хроматина. Последние называются гистонами и имеют ярко выраженные основные свойства, обусловленные присутствием в полимерной цепи большого количества аминогрупп.
Поведение протеинов в электрическом поле
В практических целях часто возникает необходимость в разделении, например, белков крови, на фракции или индивидуальные макромолекулы. Для этого можно использовать способность заряженных молекул полимера двигаться с определенной скоростью к электродам в электрическом поле. Раствор, содержащий разные по массе и заряду пептиды, помещают на носитель: бумагу или специальный гель. Пропуская электрические импульсы, например, через порцию плазмы крови, получают до 18 фракций отдельных белков. Среди них: все виды глобулинов, а также белок альбумин, являющийся не только важнейшим составным компонентом (на него приходится до 60 % массы пептидов кровяной плазмы), но и играющим центральную роль в процессах осмоса и циркуляции крови.
Как влияет на растворимость белка концентрация солей
Способность пептидов образовывать не только гели, пены и эмульсии, но и растворы – важное свойство, отражающее их физико-химическую характеристику. Например, ранее изученные альбумины, находящиеся в эндосперме семян зерновых культур, молоке и сыворотке крови, быстро образуют водные растворы с концентрацией нейтральных солей, например, таких, как хлорид натрия, в интервале от 3 до 10 процентов. На примере тех же альбуминов можно выяснить зависимость растворимости белка от концентрации соли. Они хорошо растворяются в ненасыщенном растворе сульфата аммония, а в пересыщенном – обратимо осаждаются и при дальнейшем снижении концентрации соли путем добавления порции воды восстанавливают свою гидратную оболочку.
Высаливание
Выше описанные химические реакции пептидов с растворами солей, образованных сильной кислотой и щелочью, называются высаливанием. В его основе лежит механизм взаимодействия заряженных функциональных групп белка с ионами солей – катионами металлов и анионами кислотных остатков. Он заканчивается потерей заряда на пептидной молекуле, уменьшением ее водной оболочки, слипанием частиц белка. В результате происходит их осаждение, на котором мы остановимся далее.
Осаждение и денатурация
Ацетон и этиловый спирт разрушают водную оболочку, окружающую белок в третичной структуре. Однако это не сопровождается нейтрализацией общего заряда на нем. Такой процесс называется осаждением, растворимость белка резко снижается, но не заканчивается денатурацией.
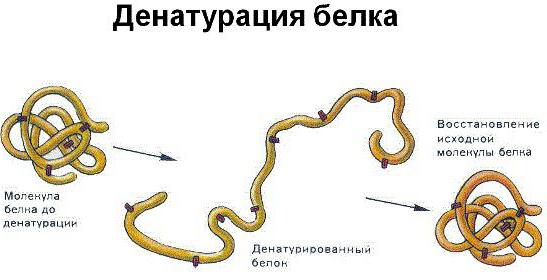
Молекулы пептидов, находящихся в нативном состоянии, очень чувствительны ко многим параметрам внешней среды, например, к температуре и концентрации химических соединений: солей, кислот или щелочей. Усиление действия обоих этих факторов в изоэлектрической точке приводит к полному разрушению стабилизирующих внутримолекулярных (дисульфидные мостики, пептидные связи), ковалентных и водородных связей в полипептиде. Особенно быстро в таких условиях денатурируют глобулярные пептиды, при этом полностью утрачивая свои физико-химические и биологические свойства.


























