Отдельные элементы основ химической термодинамики начинают рассматривать еще в средней школе. На уроках химии ученики впервые сталкиваются с такими понятиями, как обратимые и необратимые процессы, химическое равновесие, тепловой эффект и многими другими. Из школьного курса физики они узнают о внутренней энергии, работе, потенциалах и даже знакомятся с первым началом термодинамики.

Определение термодинамики
Студенты вузов и ссузов химико-технологических специальностей подробно изучают термодинамику в рамках физической и/или коллоидной химии. Это один из основополагающих предметов, понимание которого позволяет выполнять расчеты, необходимые для разработки новых технологических линий производства и оборудования для них, решения проблем в уже имеющихся технологических схемах.
Химической термодинамикой принято называть один из разделов физической химии, изучающий химические макросистемы и связанные с ними процессы на основе общих законов о превращениях теплоты, работы и энергии друг в друга.
Она основана на трех постулатах, которые чаще называют началами термодинамики. Они не имеют математической основы, а базируются на обобщении опытных данных, которые накоплены человечеством. Из этих законов выведены многочисленные следствия, положенные в основу описания окружающего мира.
Задачи
К основным задачам химической термодинамики можно отнести:
- доскональное изучение, а также объяснение важнейших закономерностей, которые определяют направление химических процессов, скорости их протекания, условия, оказывающие на них влияние (среда, примеси, излучения и прочее);
- расчет энергетического эффекта какого-либо химического или физико-химического процесса;
- выявление условий максимального выхода продуктов реакции;
- определение критериев состояния равновесия различных термодинамических систем;
- установление необходимых критериев для самопроизвольного протекания того или иного физико-химического процесса.

Предмет и объект
Данный раздел науки не ставит перед собой цели объяснить природу или механизм какого-либо химического явления. Ее интересует исключительно энергетическая сторона происходящих процессов. Поэтому предметом химической термодинамики можно назвать энергию и законы превращения энергии в ходе химических реакций, растворении веществ при испарении и кристаллизации.
Эта наука дает возможность судить о том, способна ли протекать та или иная реакция в определенных условиях именно с энергетической стороны вопроса.
Объектами ее изучения называют тепловые балансы физико-химических процессов, фазовые переходы и химические равновесия. Причем только в макроскопических системах, то есть таких, которые состоят из огромного числа частиц.
Методы
Термодинамический раздел физической химии для решения основных своих задач пользуется теоретическими (расчетными) и практическими (экспериментальными) методами. Первая группа методов позволяет количественно связать разные свойства, и рассчитать одни из них, основываясь на опытных величинах других, пользуясь принципами термодинамики. Законы квантовой механики помогают установить способы описания и особенности движения частиц, связать величины, характеризующие их, с физическими параметрами, определяемыми в ходе опытов.
Исследовательские методы химической термодинамики делят на две группы:
- Термодинамические. Они не учитывают природу конкретных веществ, не базируются ни на каких модельных представлениях об атомно-молекулярном строении веществ. Такие методы принято называть феноменологическими, то есть устанавливающими связи между наблюдаемыми величинами.
- Статистические. Они основываются на строении вещества и квантовых эффектах, позволяют описывать поведение систем, опираясь на анализ процессов, происходящих на уровне атомов и составляющих их частиц.

Оба этих подхода имеют свои достоинства и недостатки.
| Метод | Достоинства | Недостатки |
| Термодинамический | В связи с большой общностью достаточно прост и не требует дополнительных сведений, при этом решает конкретные задачи | Не раскрывает механизм процесса |
| Статистический | Помогает понять суть и механизм явления, поскольку основан на представлениях об атомах и молекулах | Требует основательной подготовки и большого объема знаний |
Основные понятия химической термодинамики
Система – это любой материальный макроскопический объект изучения, обособленный от внешней среды, причем граница может быть как реальной, так и воображаемой.
Типы систем:
- закрытая (замкнутая) - характеризуется постоянством общей массы, не происходит обмена веществом с внешней средой, однако энергетически обмен возможен;
- открытая - обменивается с окружающей средой и энергией, и веществом;
- изолированная - не обменивается с внешней средой ни энергией (теплотой, работой), ни веществом, при этом имеет постоянный объем;
- адиабатически-изолированная - не имеет только теплового обмена с внешней средой, но может быть связана с ней работой.
Для обозначения способа обмена энергией и веществом используют понятия тепловых, механических и диффузионных контактов.
Параметрами состояния системы называют любые измеряемые макрохарактеристики состояния системы. Они могут быть:
- интенсивными – не зависящими от массы (температура, давление);
- экстенсивными (емкостными) – пропорциональными массе вещества (объем, теплоемкость, масса).
Все эти параметры заимствованы химической термодинамикой у физики и химии, но приобретают несколько иное содержание, поскольку рассматриваются в зависимости от температуры. Именно благодаря этой величине различные свойства связываются между собой.
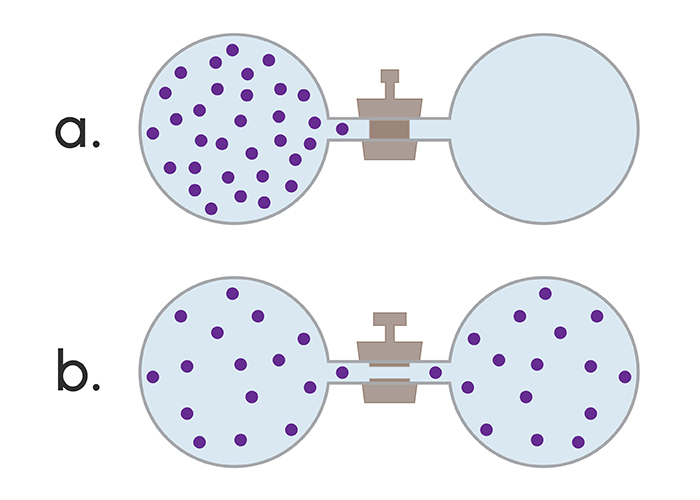
Равновесным называют такое состоянием системы, в которое она приходит при постоянстве внешних условий и характеризуется временным постоянством термодинамических параметров, а также отсутствием в ней вещественных и тепловых потоков. Для данного состояния наблюдается постоянство давления, температуры и химического потенциала во всем объеме системы.
Равновесные и неравновесные процессы
В системе основных понятий химической термодинамики особое место занимает термодинамический процесс. Его определяют как изменения в состоянии системы, которые характеризуются изменениями одного или нескольких термодинамических параметров.
Изменения в состоянии системы возможны при разных условиях. В связи с этим различают равновесные и неравновесные процессы. Равновесный (или квазистатический) процесс рассматривается как ряд равновесных состояний какой-либо системы. При этом все параметры ее изменяются бесконечно медленно. Для протекания такого процесса необходимо соблюдение ряда условий:
- Бесконечно малая разница в значениях действующих и противодействующих сил (внутренне и внешнее давление и прочее).
- Бесконечно малая скорость процесса.
- Максимальная работа.
- Бесконечно малое изменение внешней силы меняет направление течение процесса на обратный.
- Значения работ прямых и обратных процессов равны, а пути их совпадают.
Процесс изменения неравновесного состояния системы на равновесное называют релаксацией, а длительность его – временем релаксации. В химической термодинамике зачастую принимают наибольшее значение времени релаксации для какого-либо процесса. Связано это с тем, что реальные системы легко выходят из состояния равновесия возникающими потоками энергии и/или вещества в системе и являются неравновесными.
Обратимые и необратимые процессы
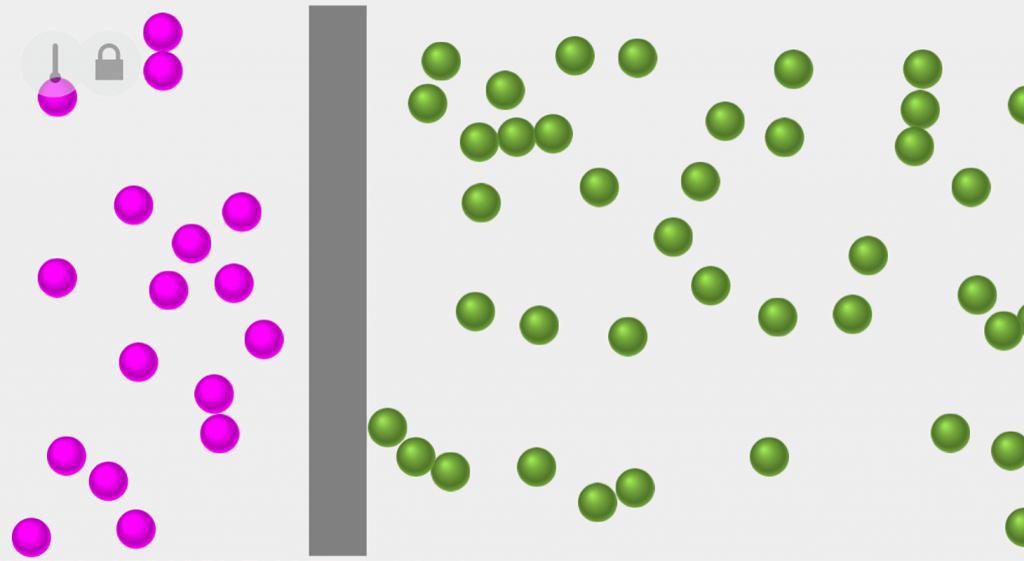
Обратимым термодинамическим процессом называют переход системы из одного ее состояния в другое. Он может протекать не только в прямом направлении, но и в обратном, причем через одни и те же промежуточные состояния, при этом изменений в окружающей среде наблюдаться не будет.
Необратимым называют процесс, для которого невозможен переход системы из одного ее состояние в другое, не сопровождающийся изменениями в окружающей среде.
Необратимыми процессами являются:
- теплопередача при конечной разности температур;
- расширение газа в вакууме, поскольку при нем не совершается работа, а сжать газ без ее совершения невозможно;
- диффузия, так как после удаления газы легко будут взаимно диффундировать, а обратный процесс без совершения работы невозможен.
Другие виды термодинамических процессов
Круговым процессом (циклом) называют такой процесс, в ходе которого система характеризовалась изменением своих свойств, а в его конце вернулась к исходным значениям.
В зависимости от значений температуры, объема и давления, характеризующих процесс, в химической термодинамике различают следующие его виды:
- Изотермический (T = const).
- Изобарический (P = const).
- Изохорический (V = const).
- Адиабатический (Q = const).
Законы химической термодинамики
Прежде чем рассматривать основные постулаты, необходимо вспомнить суть величин, характеризующих состояние различных систем.
Под внутренней энергией U системы понимают запас ее энергии, складывающийся из энергий движения и взаимодействия частиц, то есть всех видов энергии за исключением кинетической энергии и ее потенциальной энергии положения. Определить ее изменение ∆U.
Энтальпию Н часто называют энергией расширенной системы, а также ее теплосодержанием. H=U+pV.

Теплотой Q называют неупорядоченную форму передачи энергии. Внутренняя теплота системы считается положительной (Q > 0), если тепло поглощается (эндотермический процесс). Отрицательна (Q < 0) она в том случае, если тепло выделяется (экзотермический процесс).
Работой А называют упорядоченную форму передачи энергии. Она считается положительной (A>0), если совершается системой против внешних сил, и отрицательной (A<0), если осуществляется внешними силами над системой.
Основным постулатом является первое начало термодинамики. Существует множество его формулировок, среди которых можно выделить следующую: "Переход энергии из одного вида в другой происходит в строго эквивалентных количествах".
Если система осуществляет переход из состояния 1 в состояние 2, сопровождающийся поглощением теплоты Q, которая, в свою очередь, тратится на изменение внутренней энергии ∆U и совершение работы А, то математически этот постулат записывается уравнениями: Q=∆U+A или δQ = dU + δA.
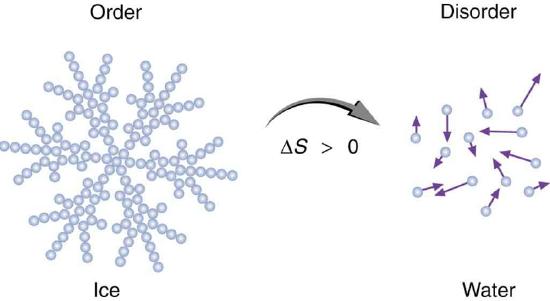
Второй закон термодинамики, как и первый, не выведен теоретически, а носит статус постулата. Однако его достоверность подтверждают следствия из него соответствующие экспериментальным наблюдениям. В физической химии чаще встречается следующая формулировка: "У любой изолированной системы, которая не находится в состоянии равновесия, энтропия возрастает с течением времени, причем продолжается ее рост, пока система не войдет в состояние равновесия".
Математически этот постулат химической термодинамики имеет вид: dSизол≥0. Знак неравенства в данном случае указывает на неравновесность состояния, а знак "=" на равновесие.



























