Среди соединений азота с водородом особое место принадлежит аммиаку. Он является важнейшим продуктом химического производства и применяется во многих отраслях деятельности человека. В нашей статье мы ознакомимся с молярной массой аммиака и изучим его основные физические и химические свойства.
Строение молекулы
Вещество имеет формулу NH3, атомы водорода связаны с центральной частицей азота ковалентными полярными связями. Общие электронные пары сильно смещены к атому азота, поэтому молекулы представляют собой диполи. Между ними возникают слабые водородные связи, которые обуславливают прекрасную растворимость соединения в воде. Так, один ее объем может поглотить до 700 частей NH3. Молярная масса аммиака составляет 17 г/моль. Раствор вещества в воде называют нашатырным спиртом или аммиачной водой. Его применяют в медицине при обморочных состояниях, так как вдыхание паров вещества возбуждает центры дыхания в коре головного мозга.
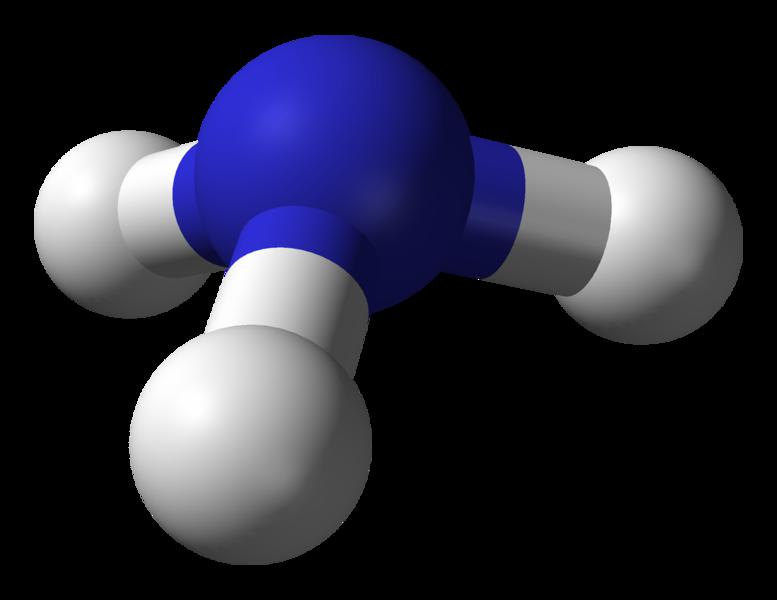
Физическая характеристика
Газообразный аммиак почти вдвое легче воздуха, не имеет цвета. При охлаждении до -33,4 или увеличении давления он быстро сжижается, переходя в бесцветную жидкую фазу. Газ легко распознают, так как запах аммиака специфический и очень резкий.
Соединение легко растворяется в воде, образуя нашатырный спирт. При его кипячении молекулы NH3 быстро испаряются. Аммиак является токсическим веществом, поэтому все химические опыты с ним требуют проведения под вытяжкой с большой осторожностью. Вдыхание паров газа вызывает раздражение слизистой оболочки органа зрения, боль в желудке и одышку.

Гидроксид аммония
В растворе аммиачной воды присутствует три вида частиц: гидраты аммиака, анионы гидроксильных групп и катионы аммония NH4+. Присутствие гидроксид-ионов придает раствору нашатырного спирта щелочную реакцию. Ее можно обнаружить с помощью индикаторов, например, бесцветного фенолфталеина, который в аммиачной воде становится малиновым. В процессе взаимодействия гидроксильных анионов с катионами аммония вновь образуются частицы аммиака, молярная масса которого составляет 17 г/моль, а также молекулы воды. При их взаимодействии между собой, частицы связываются водородными связями. Поэтому водный раствор вещества можно выразить формулой NH4OH, он получил название гидроксида аммония. Соединение проявляет слабые щелочные свойства.
Особенности иона NH4+
Сложный ион аммония формируется с помощью донорно-акцепторного механизма образования ковалентной связи. Атом азота выступает в роли донора и предоставляет два своих электрона, которые становятся общими. Ион водорода отдает свободную ячейку, становясь акцептором. В результате соединения катионов аммония и гидроксид-ионов появляются молекулы аммиака, запах которого ощущается сразу, и воды. Равновесие реакции смещается влево. Во многих веществах частицы аммония аналогичны положительным ионам одновалентных металлов, например, в формулах солей: NH4Cl, (NH4)2SO4 – хлориде и сульфате аммония.

Реакции с кислотами
Аммиак вступает в реакции со многими неорганическими кислотами с образованием соответствующих солей аммония. Например, в результате взаимодействия хлоридной кислоты и NH3 получим хлористый аммоний:
NH3 + HCl = NH4Cl
Это реакция присоединения. Соли аммония при нагревании разлагаются, при этом выделяется газообразный аммиак, температура кипения которого составляет -33,34 °C. Они также имеют хорошую растворимость в воде и способны к гидролизу. Соли аммония при нагревании разлагаются, при этом выделяется газообразный аммиак. Они также имеют хорошую растворимость в воде и способны к гидролизу. Если соль аммония образована сильной кислотой, то раствор ее имеет кислую реакцию. Она обусловлена избыточным количеством ионов водорода, которые можно обнаружить с помощью индикатора – лакмуса, изменяющего свою фиолетовую окраску на красную.
Как измеряется молярная масса
Если порция вещества содержит 6,02×1023 структурных единиц: молекул, атомов или ионов, то речь идет о величине, которая называется числом Авогадро. Она соответствует молярной массе, г/моль – это единица ее измерения. Например, в 17 граммах аммиака содержится число Авогадро молекул или 1 моль вещества, а в 8,5 граммах – 0,5 моль и т. д. Молярная масса – специфическая единица, применяемая в химии. Она не равнозначна физической массе. Существует еще одна единица измерения, которая используется при химических расчетах. Это масса 1 моля эквивалента аммиака. Она равна произведению молярной массы на фактор эквивалентности. Именуется молярной массой эквивалента аммиака и имеет размерность - моль/л.

Химические свойства
Газообразный аммиак – горючее вещество. В атмосфере кислорода или горячего воздуха он сгорает с образованием свободного азота и паров воды. Если в реакции применять катализатор (платину или окись трехвалентного хрома), то продукты процесса будут другими. Это - монооксид азота и вода:
NH3+O2→NO+H2O
Эту реакцию называют каталитическим окислением аммиака. Она является окислительно-восстановительной, в ней аммиак, молярная масса равна 17 г/моль, проявляет сильные восстановительные свойства. Он способен также реагировать с оксидом меди, восстанавливая его до свободной меди, газообразного азота и воды. Газ может реагировать с концентрированной соляной кислотой и в отсутствии воды. Известен опыт, который называют: дым без огня. Одну стеклянную палочку погружают в нашатырный спирт, а другую – в концентрированную хлоридную кислоту, затем их сближают. Наблюдают появление белого дыма, который выделяют образующиеся мелкие кристаллы хлорида аммония. Такого же эффекта можно добиться, если поставить пробирки с двумя растворами рядом. Уравнение аммиака с хлоридной кислотой было приведено нами выше.
При сильном нагревании молекулы вещества разлагаются на свободный азот и водород:
2NH3 ⇄ N2 + 3H2
Как распознать ион NH4+
Соли аммония реагируют не только с кислотами, но и со щелочами. В результате выделяется газообразный аммиак, что легко определяют органом обоняния. Это доказывает, что данная соль содержит ион аммония.
Более точным показателем того, что при взаимодействии щелочи и сульфата аммония выделяется катион NH4+,служит влажная универсальная лакмусовая бумага. Она изменяет свой цвет с красного на синий.
Промышленный синтез аммиака
Газообразное соединение добывают прямой реакцией соединения водорода, полученного конверсией из воды, и азота, выделенного из воздуха. Процесс является каталитическим (используют металлическое железо, содержащее примеси окислов калия и алюминия). При этом учитывают тот факт, что температура кипения аммиака составляет -33,4 °С. Экзотермическая реакция синтеза аммиака требует повышения давления в реагирующей газовой смеси до 450 – 460 °С. Чтобы повысить практический выход продукта в обратимой реакции синтеза аммиака, регулируют чистоту реагентов, не допускают повышения температуры в колонне синтеза.

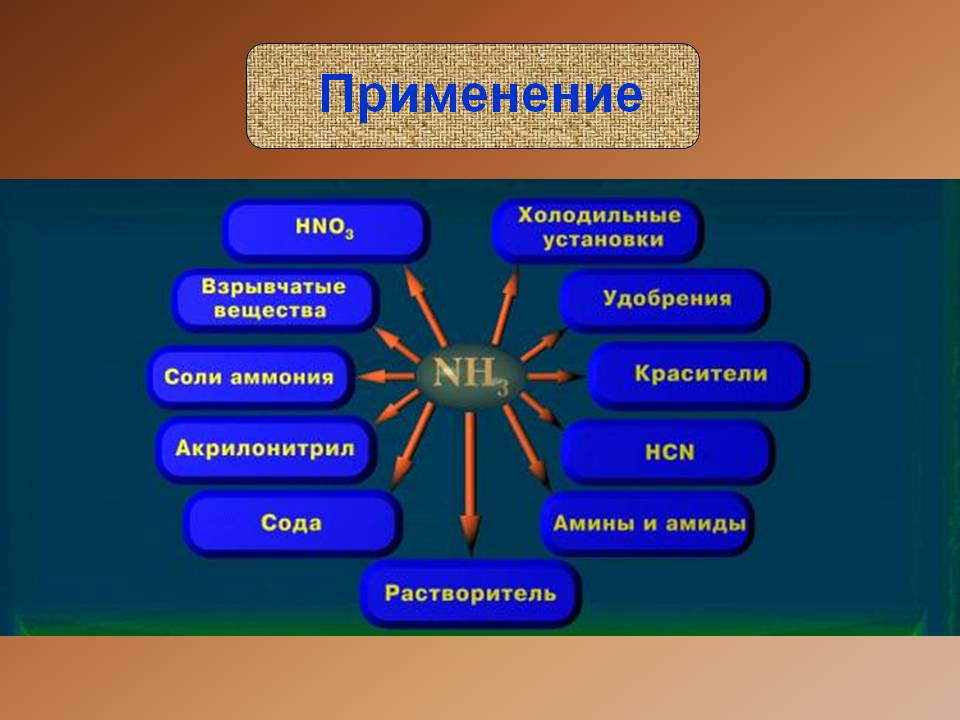
Где применяют аммиак и его соли
Физические и химические характеристики вещества обуславливают его использование в различных сферах промышленности. Наибольшее его количество используют для синтеза нитратной кислоты, азотсодержащих солей аммония, соды по аммиачному способу, карбамида. В холодильных установках вещество применяют, благодаря его способности испаряться, одновременно поглощая избыток тепла. Аммиачную воду и жидкий аммиак используют в качестве азотного удобрения.



























