Алканы, или же парафиновые углеводороды - это простейший из всех классов органических соединений. Основная их характеристика - присутствие в молекуле только одинарных, или насыщенных связей, откуда берется другое название - насыщенные углеводороды. Кроме всем известных нефти и газа, алканы также содержатся во многих растительных и животных тканях: например, феромоны мухи цеце - алканы, содержащие в своих цепочках 18, 39 и 40 атомов углерода; также алканы в большом количестве содержатся в верхнем защитном слое растений (кутикуле).
Общие сведения
Алканы относятся к классу углеводородов. Это значит, что в формуле любого соединения будут присутствовать только углерод (С) и водород (H). Отличает их лишь то, что все связи в молекуле одинарные. Валентность углерода - 4, следовательно, один атом в соединении всегда будет связан с четырьмя другими атомами. Причем как минимум одна связь будет вида углерод-углерод, а остальные могут быть как углерод-углеродные, так и углерод-водородные (валентность водорода - 1, так что о водород-водородных связях думать запрещено). Соответственно, атом углерода, имеющий только одну C-C связь, будет называться первичным, две C-C связи - вторичным, три - третичным и четыре, по аналогии, четвертичным.
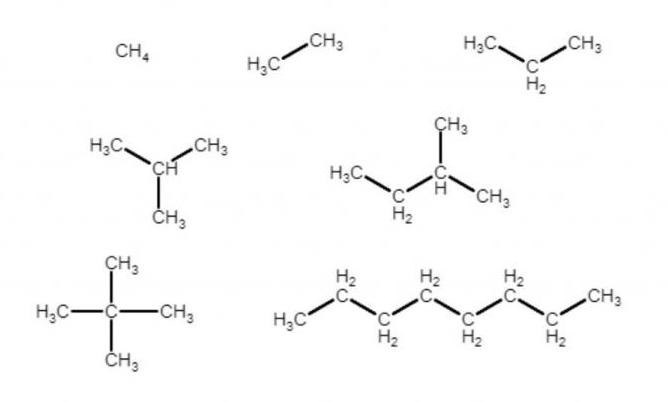
Если записать молекулярные формулы всех алканов на рисунке, получится:
- CH4,
- C2H6,
- C3H8.
и так далее. Нетрудно составить универсальную формулу, описывающую любое соединение этого класса:
- CnH2n+2.
Это общая формула парафиновых углеводородов. Совокупность всех возможных формул для них составляет гомологический ряд. Разница между двумя ближайшими членами ряда составляет (-CH2-).
Номенклатура алканов
Первый и простейший в ряду насыщенных углеводородов - метан CH4. Далее идет этан C2H6, имеющий два атома углерода, пропан C3H8, бутан C4H10, а с пятого члена гомологического ряда алканы называются по количеству атомов углерода в молекуле: пентан, гексан, гептан, октан, нонан, декан, ундекан, додекан, тридекан и так далее. Однако "разом" несколько углеродов можно назвать, только если они находятся в одной линейной цепочке. А так бывает не всегда.

На данной картинке изображено несколько структур, молекулярные формулы которых совпадают: C8H18. Однако перед нами - три разных соединения. Такое явление, когда для одной молекулярной формулы существует несколько различных структурных, называется изомерией, а соединения - изомерами. Здесь наблюдается изомерия углеродного скелета: это значит, что изомеры отличаются порядком углерод-углеродных связей в молекуле.
Все изомеры, не обладающие линейной структурой, называются разветвленными. В их номенклатуре берут за основу самую длинную непрерывную цепочку из атомов углерода в молекуле, а "ответвления" считаются заместителями одного из атомов водорода при углероде из "основной" цепочки. Так получаются 2-метилпропан (изобутан), 2,2-диметилпропан (неопентан), 2,2,4-триметилпентан. Цифра указывает на номер углерода основной цепочки, далее следует количество одинаковых заместителей, далее название заместителя, далее имя основной цепочки.
Строение алканов
Все четыре связи у атома углерода - ковалентные сигма-связи. Для образования каждой из них углерод использует одну из своих четырех орбиталей на внешнем энергетическом уровне - 3s (одна штука), 3p (три штуки). Ожидается, что раз в связывании участвуют разные типы орбиталей, то и получившиеся связи по своим энергетическим характеристикам должны быть разными. Однако такого не наблюдается - в молекуле метана все четыре одинаковы.
Для объяснения этого явления используется теория гибридизации. Она работает следующим образом: принимается, что ковалентная связь - это как бы два электрона (по одному от каждого атома в паре), находящиеся ровно между связанными атомами. В метане, например, четыре таких связи, поэтому четыре пары электронов в молекуле будут отталкиваться друг от друга. Чтобы минимизировать это постоянное толкание, центральный атом в метане располагает все четыре своих связи таким образом, чтобы они находились как можно дальше друг от друга. При этом, для еще большей выгоды, он как бы смешивает все свои орбитали (3s - одна и 3p - три), делая из них затем четыре новые одинаковые sp3-гибридные орбитали. В итоге "концы" ковалентных связей, на которых расположены атомы водорода, образуют правильный тетраэдр, в середине которого находится углерод. Такой финт ушами называется sp3-гибридизацией.
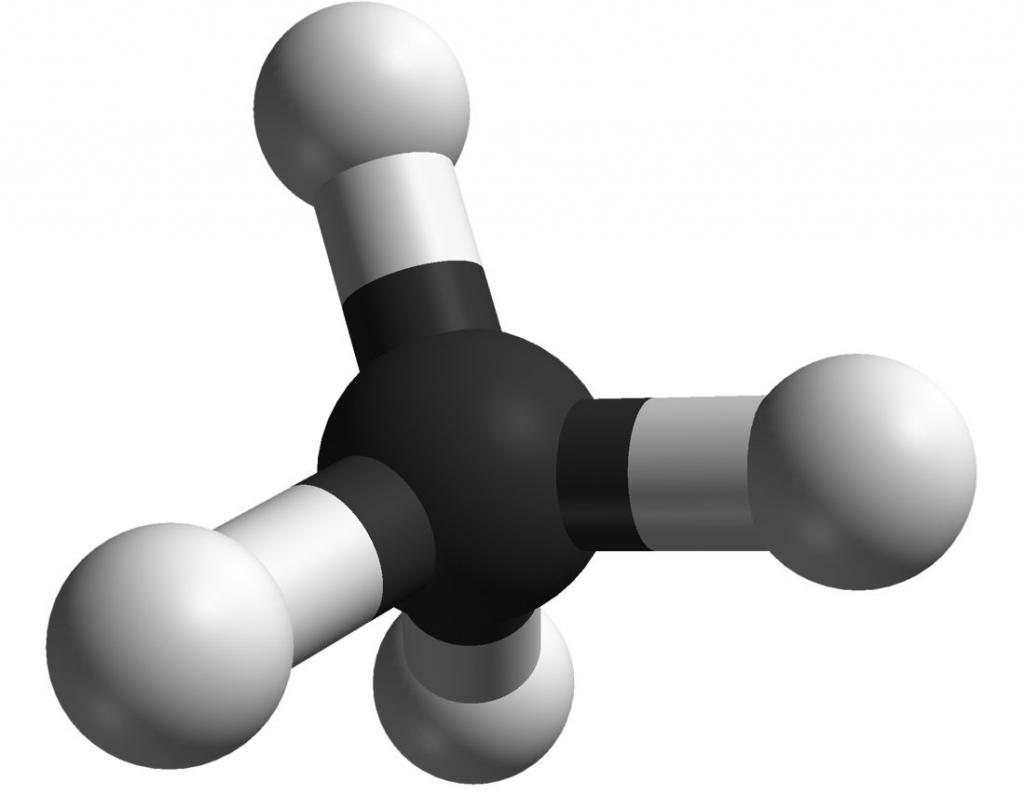
Все атомы углерода в алканах находятся в sp3-гибридизации.
Физические свойства
Алканы с количеством атомов углерода от 1 до 4 - газы, от 5 до 17 - жидкости с резким запахом, похожим на запах бензина, выше 17 - твердые вещества. Температуры кипения и плавления у алканов возрастают вместе с тем, как возрастает их молярная масса (и, соответственно, количество атомов углерода в молекуле). Стоит сказать, что при одинаковой молярной массе разветвленные алканы имеют заметно более низкие температуры плавления и кипения, чем их неразветвленные изомеры. Это значит, что межмолекулярные связи в них слабее, поэтому общая структура вещества менее устойчива к внешним воздействиям (и при нагревании эти связи быстрее разрушаются).
Несмотря на такие различия, в среднем все алканы крайне неполярны: в воде они практически не растворяются (а вода - полярный растворитель). Зато сами ненасыщенные углеводороды из тех, что в нормальных условиях являются жидкостями, активно используются в качестве неполярных растворителей. Так используют н-гексан, н-гептан, н-октан и прочие.
Химические свойства
Алканы малоактивны: даже по сравнению с другими органическими веществами они реагируют с крайне ограниченным списком реактивов. В основном это реакции, протекающие по радикальному механизму: хлорирование, бромирование, нитрование, сульфирование и прочее. Хлорирование метана - классический пример цепных реакций. Суть его заключается в следующем.
Цепная химическая реакция состоит из нескольких стадий.
- сначала происходит зарождение цепи - появляются первые свободные радикалы (в данном случае это происходит под действием фотонов);
- следующий этап - развитие цепи. В ходе него образуются новые вещества, являющиеся результатом взаимодействия какого-нибудь свободного радикала и молекулы; при этом высвобождаются новые свободные радикалы, которые, свою очередь, реагируют с другими молекулами, и так далее;
- когда между сталкиваются и образуют новое вещество два свободных радикала, происходит обрыв цепи - новых свободных радикалов не образуется, и в этой ветке реакция затухает.
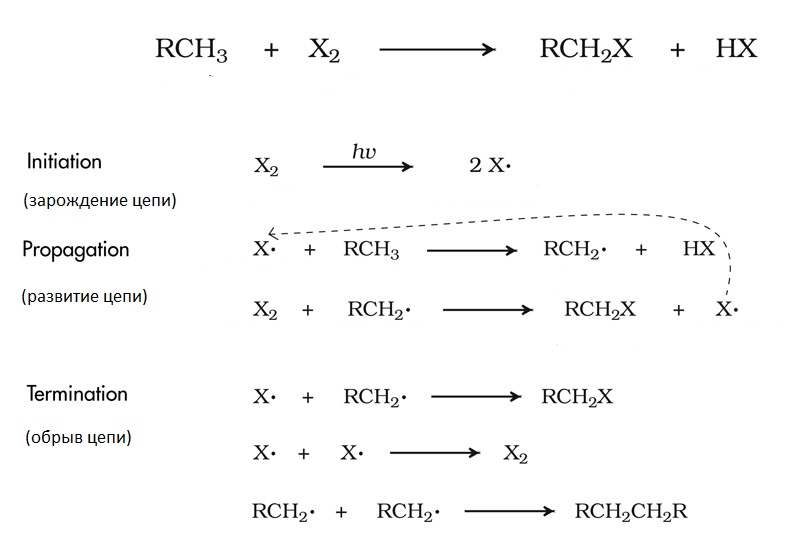
Промежуточными продуктами реакции здесь являются и хлорметан CH3Cl, и дихлорметан CH2Cl2, и трихлорметан (хлороформ) CHCl3, и тетрахлорметан CCl4. Это значит, что радикалы могут атаковать кого угодно: и собственно метан, и промежуточные продукты реакции, все больше и больше замещая водород на галоген.
Крайне важная для промышленности реакция - это изомеризация парафиновых углеводородов. В ходе ее из неразветвленных алканов получают их разветвленные изомеры. Это повышает так называемую детонационную стойкость соединения - одну из характеристик автомобильного топлива. Реакция проводится на катализаторе хлорида алюминия AlCl3 при температурах около 300оC.
Горение алканов
Еще с начальной школы многие знают, что любое органическое соединение сгорает с образованием воды и углекислого газа. Алканы не являются исключением; однако в данном случае гораздо важнее другое. Свойство парафиновых углеводородов, особенно газообразных - выделение при сгорании большого количества тепла. Именно поэтому практически все основные виды топлива производятся из парафинов.

Полезные ископаемые на основе углеводородов
Это - останки древних живых организмов, прошедшие долгий путь химических изменений без доступа кислорода. Природный газ в среднем на 95% состоит из метана. Остальную часть занимают этан, пропан, бутан и незначительные примеси.
С нефтью все гораздо интереснее. Она представляет собой целый букет самых разнообразных классов углеводородов. Но основную часть занимают алканы, циклоалканы и ароматические соединения. Парафиновые углеводороды нефтей разделяются на фракции (куда входят и ненасыщенные соседи) по количеству атомов углерода в молекуле:
- газолин (5-7 С);
- бензин (5-11 С);
- лигроин (8-14 С);
- керосин (12-18 С);
- газойль (16-25 С);
- масла - мазут, соляровое, смазочное и прочие (20-70 С).

В соответствии с фракцией, нефтяное сырье идет на разные виды топлива. По этой причине виды топлива (бензин, лигроин - тракторное топливо, керосин - реактивное, дизельное топливо) совпадают с фракционной классификацией парафиновых углеводородов.



























