Возьмем самый простой несимметричный и ненасыщенный углеводород и самый простой симметричный и ненасыщенный. Ими окажутся соответственно пропен и бутен-2. Это алкены, и они любят вступать в реакции присоединения. Пусть, например, это будет присоединение бромоводорода. В случае с бутеном-2 возможен только один продукт - 2-бромбутан, к какому из атомов углерода бром ни присоединился бы - они все равноценны. А в случае с пропеном возможно два варианта: 1-бромпропан и 2-бромпропан. Однако экспериментально было доказано, что в продуктах реакции гидрогалогенирования 2-бромпропан заметно преобладает. То же самое верно для реакции гидратации: пропанол-2 будет основным продуктом.
Чтобы объяснить эту закономерность, Марковников сформулировал правило, которое и называется его именем.
Правило Марковникова

Распространяется на несимметричные алкены и алкины. При присоединении воды или галогеноводородов к таким молекулам их водород отправляется к наиболее гидрогенизированному атому углерода в двойной связи (то есть к такому, который содержит больше всего атомов углерода при себе). Это работает на последнем примере с пропеном: центральный атом углерода имеет при себе лишь один водород, а тот, что с краю, - целых два, поэтому бромоводород водородом цепляется за крайний атом углерода, а бромом - за центральный, и получается 2-бромпропан.
Конечно, правило соткано не из воздуха, и ему имеется нормальное объяснение. Однако для этого придется подробнее изучить механизм реакции.
Механизм реакции присоединения
Реакция проходит в несколько стадий. Начинается с того, что органическую молекулу атакует катион водорода (протон, в общем); атакует он один из атомов углерода при двойной связи, потому что электронная плотность там повышена. Положительно заряженный протон всегда ищет области с повышенной электронной плотностью, поэтому его (и другие частицы, ведущие себя так же) называют электрофилом, а механизм реакции, соответственно, - электрофильным присоединением.
Протон атакует молекулу, проникает в нее, и образуется положительно заряженный карбониевый ион. И тут как раз таки находится объяснение правилу Марковникова: карбкатион образуется самый устойчивый из всех возможных, а вторичный катион устойчивее первичного, третичный устойчивее вторичного и так далее (есть еще много способов стабилизировать карбкатион). А потом все легко - отрицательно заряженный галоген, или OH-группа присоединяются к положительному заряду, и образуется конечный продукт.
Если сначала вдруг образовался какой-то неудобный карбкатион, он может перегруппироваться так, чтобы было удобно и устойчиво (с этим связан такой интересный эффект, что иногда в ходе таких реакций присоединяемый галоген или гидроксильная группа оказываются вообще у другого атома углерода, не имевшего отношения к двойной связи, просто потому что положительный заряд в карбкатионе сместился в наиболее устойчивое положение).
Что может повлиять на правило?
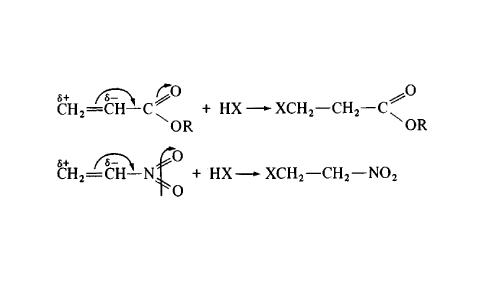
Поскольку оно основано на распределении электронной плотности в карбкатионе, влиять могут разного рода заместители, находящиеся в органической молекуле. Например, карбоксильная группа: в ней есть кислород, зацепившийся с углеродом через двойную связь, и он оттягивает электронную плотность из двойной связи на себя. Поэтому в акриловой кислоте устойчивый карбкатион - на конце цепочки (подальше от карбоксильной группы), то есть такой, что в нормальных условиях был бы менее выгоден. Это один из примеров, когда реакция идет против правила Марковникова, однако общий механизм электрофильного присоединения сохраняется.
Перекисный эффект Хараша

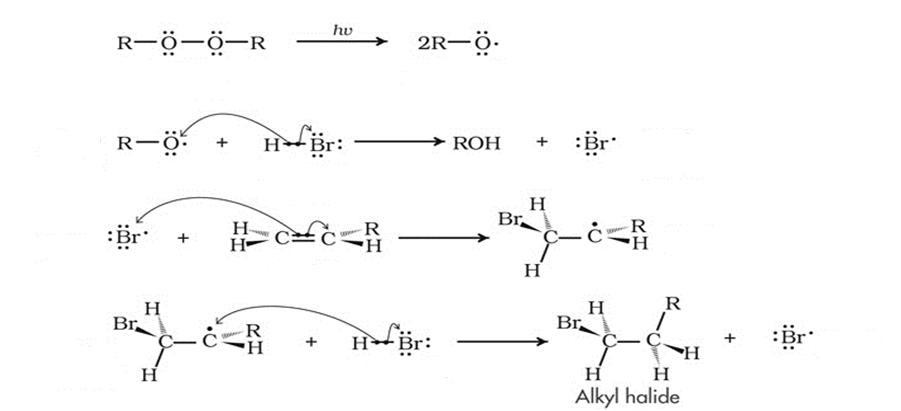
В 1933 году Моррис Хараш проводил ту же реакцию гидробромирования несимметричных алкенов, однако в присутствии перекиси. И опять продукты реакции противоречили правилу Марковникова! Эффект Хараша, как его потом назвали, заключался в том, что в присутствии перекиси меняется весь механизм реакции. Теперь он не ионный, как раньше, а радикальный. Это обусловлено тем, что перекись сама сначала разваливается на радикалы, которые дают начало цепной реакции. Потом образуется радикал брома, потом - органической молекулы с бромом. Но радикал, как и карбкатион, более устойчивый - вторичный, поэтому сам бром оказывается на конце цепи.
Вот примерное описание эффекта Хараша в химических реакциях.
Избирательность
Стоит упомянуть, что данный эффект работает только при присоединении бромоводорода. С хлороводородом и йодоводородом ничего подобного не наблюдается. Для каждого из этих соединений на то свои причины.
В хлороводороде связь между водородом и хлором достаточно сильна. И если в радикальных реакциях, инициируемых температурой и светом, энергии достаточно, чтобы ее порвать, радикалы, образующиеся при распаде перекиси, на это практически неспособны, и реакция с хлороводородом по перекисному эффекту идет очень медленно.
В йодоводороде связь рвется гораздо легче. Однако сам радикал йода оказывается с крайне низкой реакционной способностью, и эффект Хараша опять совсем почти не работает.