NH3 - одно из известнейших и полезнейших химических веществ. Оно обрело широкое применение в аграрной промышленности и не только. Отличается уникальными химическими свойствами, благодаря которым используется в различных отраслях.
Что такое NH3
Название вещества NH3 известно даже самому далекому от химии человеку. Это аммиак. Аммиак (NH3) иначе называется нитридом водорода и представляет собой при нормальных условиях бесцветный газ, обладающий ярко выраженным, характерным для данного вещества запахом. Также стоит отметить, что газ NH3 (под названием аммиак) почти в два раза легче, чем воздух!
Помимо газа, может представлять собой жидкость при температуре около 70 °С или же существовать в виде раствора (раствор аммиака). Отличительной особенностью жидкого NH3 выступает возможность растворять в себе металлы главных подгрупп I и II группы таблицы элементов Д. И. Менделеева (то есть щелочные и щелочноземельные металлы), а также магний, алюминий, европий и иттербий. В отличие от воды жидкий аммиак не взаимодействует с вышеуказанными элементами, а выступает именно в роли растворителя. Это свойство позволяет выделять металлы в исходном виде посредством испарения растворителя (NH3). На рисунке ниже можно увидеть, как выглядит растворенный в жидком аммиаке натрий.

Как выглядит аммиак с точки зрения химических связей?
Схему аммиака (NH3) и его пространственного строения наиболее наглядно показывает треугольная пирамида. Вершиной "пирамиды" аммиака является атом азота (выделен синим цветом), что видно на изображении ниже.
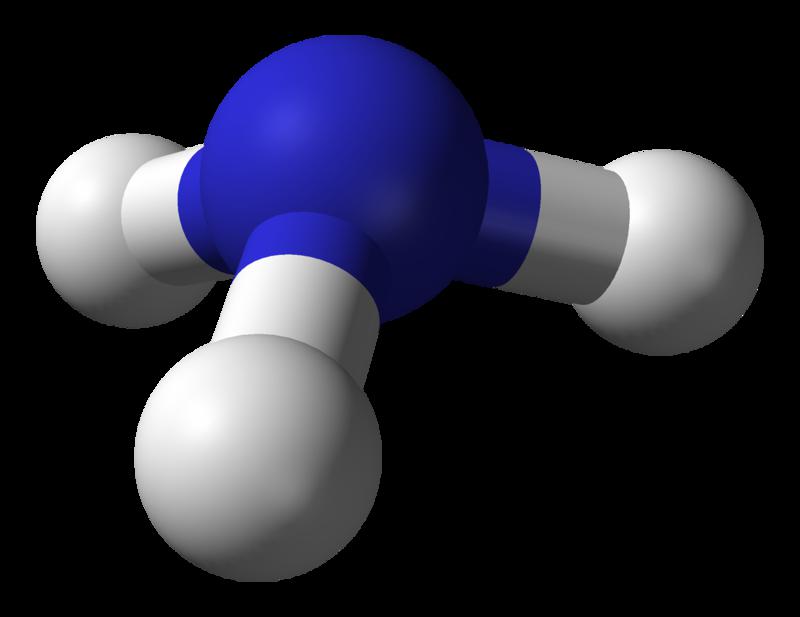
Атомы в веществе под названием аммиак (NH3) связаны водородными связями, как и в молекуле воды. Но очень важно помнить, что связи в молекуле аммиака слабее, чем в молекуле воды. Это объясняет то, что температуры плавления и кипения NH3 ниже, если сравнивать с H2O.
Химические свойства
Наиболее распространены 2 способа получения вещества NH3 под названием аммиак. В промышленности применяется так называемый процесс Габера, суть которого заключается в связывании азота воздуха и водорода (полученного из метана) посредством пропускания смеси данных газов при высоком давлении над нагретым катализатором.
В лабораториях синтез аммиака чаще всего основывается на взаимодействии концентрированного хлорида аммония с твердым гидроксидом натрия.
Приступим к непосредственному рассмотрению химических свойств NH3.
1) NH3 выступает в качестве слабого основания. Именно поэтому имеет место следующее уравнение, описывающее взаимодействие с водой:
NH3 + H2O = NH4+ + OH-
2) Также на основных свойствах NH3 основывается его способность реагировать с кислотами и образовывать соответствующие соли аммония:
NH3 + HNO3 = NH4NO3 (нитрат аммония)
3) Ранее говорилось о том, что определенная группа металлов растворяется в жидком аммиаке. Однако некоторые металлы также способны не просто растворяться, а образовывать соединения с NH3 под названием амиды:
Na(тв) + NH3(г) = NaNH2 + H2
Na(тв) + NH3(ж) = NaNH2 + H2 (реакция осуществляется в присутствии железа в качестве катализатора)
4) При взаимодействии NH3 с металлами Fe3+, Cr3+, Al3+, Sn4+, Sn2+ происходит образование соответствующих гидроксидов металлов и катиона аммиония:
Fe3+ + NH3 + H2O = Fe(OH)3 + NH4+
5) Результатом взаимодействия NH3 c металлами Cu2+, Ni2+, Co2+, Pd2+, Pt2+, Pt4+ чаще всего являются соответствующие комплексы металлов:
Cu2+ + NH3 + H2O = Cu(OH)2 + NH4+
Cu(OH)2 + NH3 = [Cu(NH3)4]2+ + OH-
Образование и дальнейший путь NH3 в организме человека
Хорошо известно, что неотъемлемой частью биохимических процессов в организме человека являются аминокислоты. Именно они являются основным источником NH3, вещества под названием аммиак, - результата их окислительного дезаминирования (чаще всего). К сожалению, для человеческого организма аммиак токсичен, из него легко образуется упомянутый выше катион аммония (NH4+), накапливающийся в клетках. Впоследствии происходит замедление важнейших биохимических циклов, а в итоге - падение уровня вырабатываемого АТФ.
Нетрудно догадаться, что организму необходимы механизмы связывания и обезвреживания выделяющегося NH3. На схеме ниже представлены источники и некоторые продукты связывания аммиака в человеческом организме.
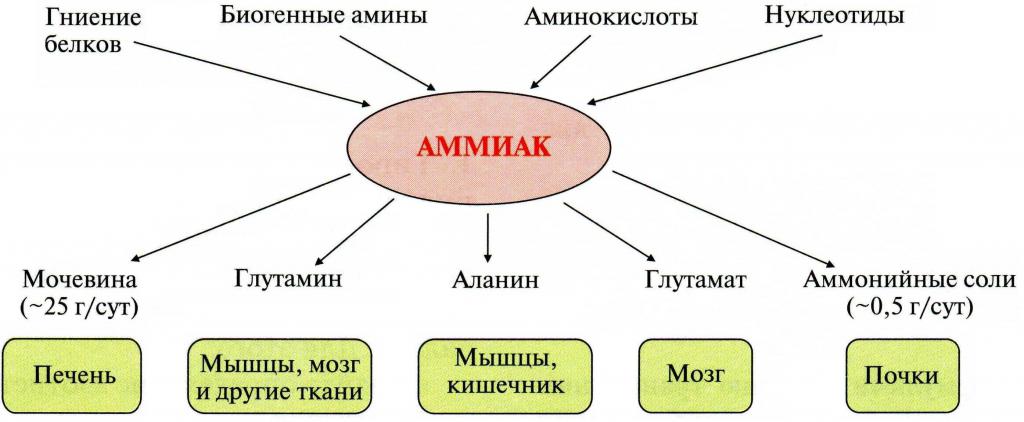
Итак, говоря кратко, обезвреживание аммиака происходит через образование его транспортных форм в тканях (например, глутамин и аланин), путем экскреции с мочой, с помощью биосинтеза мочевины, что и является основным естественным способом обезвреживания NH3 в организме человека.
Применение NH3 - вещества с названием аммиак
В современности жидкий аммиак является наиболее концентрированным и дешевым азотным удобрением, что используется в сельском хозяйстве для аммонизации грубых почв и торфа. При внесении жидкого аммиака в почве происходит рост количества микроорганизмов, но при этом не наблюдается негативных последствий, как, например, от твердых удобрений. Ниже на рисунке представлена одна из возможных установок для сжижения газообразного аммиака при помощи жидкого азота.

Испаряясь, жидкий аммиак поглощает из окружающей среды много теплоты, вызывает охлаждение. Это свойство используется в холодильных установках для получения искусственного льда при хранении скоропортящихся пищевых продуктов. Кроме того, с его помощью замораживают грунт при строительстве подземных сооружений. Водные растворы аммиака находят применение в химической промышленности (является промышленным неводным растворителем), лабораторной практике (например, в роли растворителя при электрохимическом получении химических продуктов), медицине и домашнем обиходе.


























