В ряду гемолитических заболеваний особую группу составляют патологии, вызывающие аномальную предрасположенность крови к образованию тромбов. Повышенная способность к коагуляции может иметь приобретенный или генетический характер. Согласно статистике, наиболее распространенными причинами наследственной тромбофилии являются мутации в генах F2 и F5, одна из которых носит название "фактор Лейдена".
Повышенная коагулопатия врожденного характера всегда связана с нарушениями в количестве или структуре белков, участвующих в свертывании крови. В случае мутации Лейдена она обусловлена изменением аминокислотного состава протромбина, который кодируется фактором свертываемости F5.
Мутация Лейдена - что это?
В медицине некоторые заболевания называют согласно причине их возникновения. В данном случае характер наименования патологии свидетельствует о том, что мутация Лейдена — это нарушение, связанное с аномальным изменением в определенной части человеческого генотипа. Фенотипически оно проявляется в синтезе аномальной формы одного из коагуляционных факторов, что приводит к смещению гомеостаза в сторону повышения свертываемости крови.
Таким образом, мутация Лейдена — это наследственное заболевание, выражающееся в предрасположенности к образованию аномальных сгустков, закупоривающих сосуды, и обусловленное изменением в гене, кодирующем фактор FV. Симптоматическое проявление этого дефекта характерно лишь для небольшого числа носителей патологии, но риск тромбообразования повышен у всех.
Частота встречаемости мутации гена F5 (Лейдена) одинакова и для мужчин, и женщин. Этот наследственный дефект является причиной развития тромбозов в 20-60 % случаев. Среди всего европейского населения обладателями лейденской мутации являются 5 % людей.
Общая характеристика мутации
Мутация Лейдена проявляется в полиморфизме F5-гена, что выражается в замене одного из нуклеотидов на другой. В данном случае происходит замещение аденина гуанином в позиции G1691A матричной последовательности. В результате по окончании транскрипции и трансляции синтезируется белок, первичная структура которого отличается от исходного (правильного) варианта одной аминокислотой (аргинин заменяется на глутамин). Казалось бы, незначительная разница, но именно она становится причиной нарушения регуляции свертывания крови.
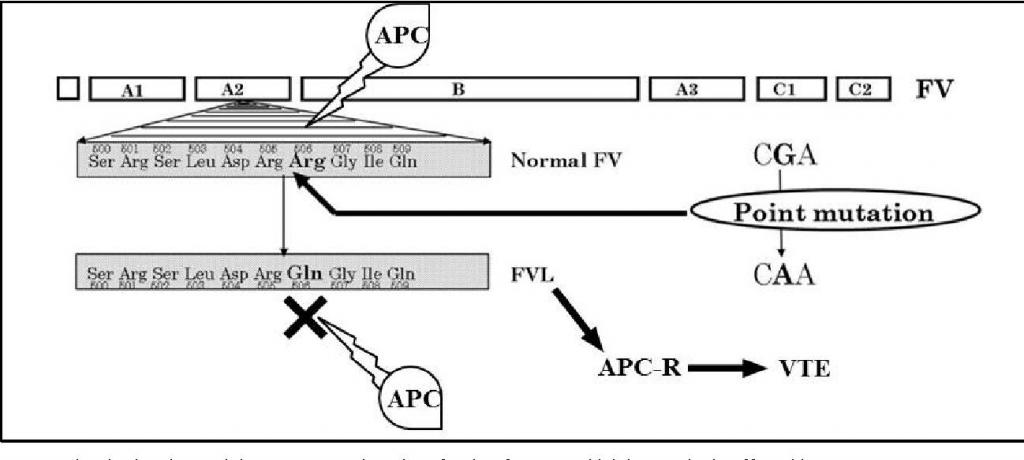
Для понимания связи между аминокислотной конверсией в белке F5 и гиперкоагуляцией необходимо разобраться в том, как образуется тромб. Ключевым моментом этого процесса является превращение фибриногена в фибрин, которому предшествует целая цепочка реакций.
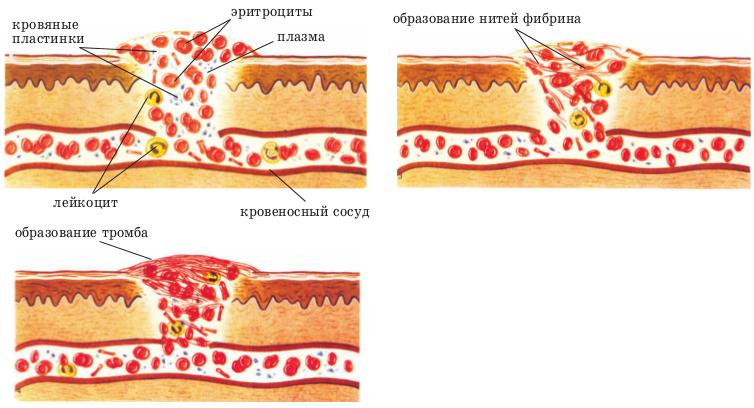
Как образуется тромб?
В основе образования тромба лежит полимеризация фибриногена, приводящая к образованию разветвленной трехмерной сети белковых нитей, в которой застревают клетки крови. В результате формируется сгусток, закупоривающий сосуд. Однако молекулы фибриногена начинают соединяться друг с другом только после протеолитической активации, которую осуществляет белок тромбин. Именно этот протеин выполняет роль поворотного рычага в схеме свертывания крови. Однако в норме тромбин присутствует в крови в виде своего предшественника — протромбина, для активации которого требуется целая цепочка последовательных реакций.
Белки, которые задействованы в этом каскаде, получили названия факторов свертываемости. Они имеют римские обозначения согласно порядку своего обнаружения. Большинство факторов являются белками. Активаторами для каждого следующего звена цепочки реакций служит предыдущее.
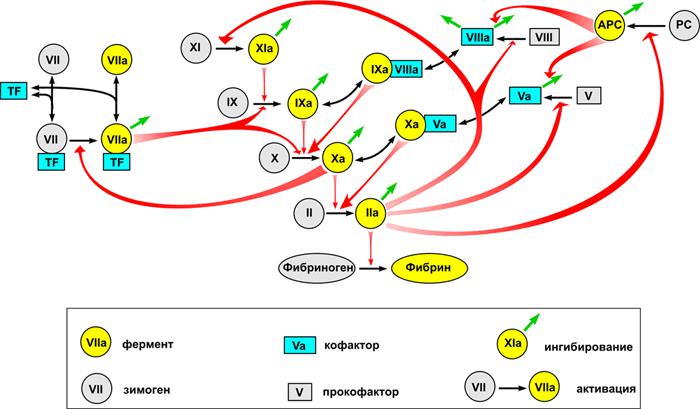
Запуск коагуляционного каскада начинается с попадания в сосуд тканевого фактора. Затем по цепочке активируются различные белки, что в конечном итоге приводит к преобразованию протромбина в тромбин. Каждый этап каскада может быть приостановлен в результате действия соответствующего ингибитора.
Фактор V
Фактор V — образующийся в печени глобулярный белок плазмы крови, участвующий в процессе коагуляции. Этот протеин иначе называется проакцелерином.
До активации тромбином белок FV имеет одноцепочечную структуру. После протеолитического расщепления с удалением D-домена молекула приобретает конформацию двух субъединиц, соединенных слабыми нековалентными связями. Такая форма проакцелерина обозначается как FVa.
Активированный белок FV выполняет функцию коэнзима для фактора свертывания крови Xa, который превращает протромбин в тромбин. Проакцелерин служит катализатором этой реакции, ускоряя ее в 350 тысяч раз. Таким образом, без фактора V завершающая стадия коагуляционного каскада длилась бы очень долго.
Механизм патологического действия мутации
Нормальный белок FV инактивируется протеином С, который вступает в действие, когда необходимо прекратить коагуляцию. Фактор С связывается с определенным сайтом FVa и переводит его в форму FV, прекращая катализ образования тромбина. При наличии мутации Лейдена синтезируется белок, который не восприимчив к действию протеина С (АРС), поскольку аминокислотная замена происходит именно на участке взаимодействия с ингибитором. Как следствие, фактор Va не может быть дезактивирован, что значительно снижает эффективность отрицательной регуляции, необходимой для остановки формирования кровяного сгустка и последующего его разжижения.
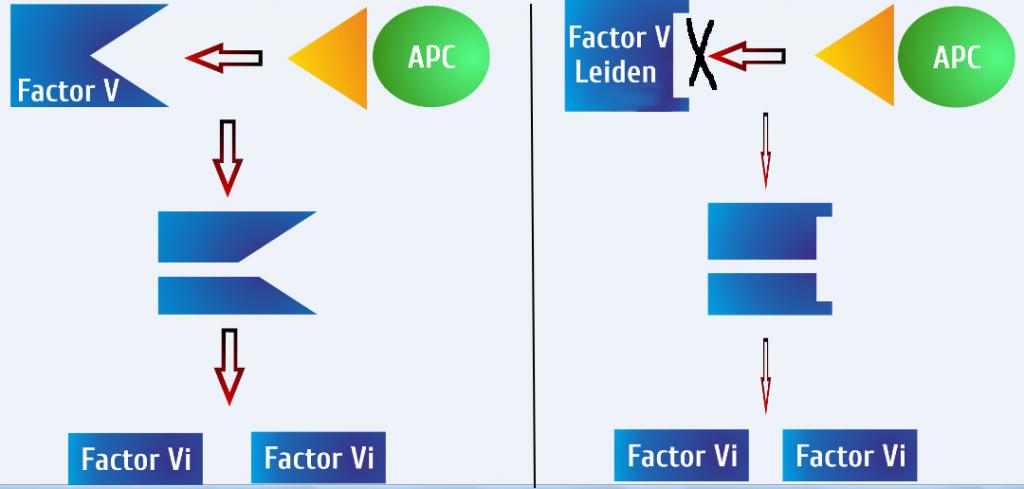
Таким образом, можно сделать вывод о том, что мутация Лейдена — это патология, проявляющаяся через сопротивление антикоагулянтной активности и таким образом повышающая риск развития тромбоза. Данное явление получило название протеин-С-резистентности.
Свойства мутантного белка
Кроме резистентности к протеину С полиморфизм гена F5 придает синтезируемому на его основе белку еще два свойства:
- способность усиливать активацию протромбина;
- увеличение кофакторной активности в отношении инактивации FVIIIa-белка, который задействован в торможении коагуляции.
Таким образом, мутантный фактор V одновременно работает в двух направлениях. С одной стороны, он запускает процесс свертывания крови, а с другой — мешает регуляторным белкам его остановить. А ведь именно механизмы супрессии (подавления) предохраняют организм от патологических проявлений многих физиологических реакций (например, воспалительных).
Таким образом, можно сказать, что мутация Лейдена — это наследственное явление, которое нарушает отрицательную регуляцию свертывания крови, повышая риск образования аномальных тромбов, вредных для нормального функционирования организма. При такой патологии один из коагуляционных факторов всегда активен.
Тем не менее ежесекундного и повсеместного образования тромбов у таких людей все же не происходит, поскольку в свертывании крови участвует множество белков, взаимосвязанных друг с другом и с системами регуляции. Поэтому нарушение работы одного фактора не приводит к радикальному сбою всего механизма ингибирования коагуляции. Во всяком случае, фактор V не является ключевым рычагом управления системой свертывания.
Как следствие, утверждать, что мутация Лейдена — это генетическое нарушение, непременно приводящее к тромбофилии, неправильно, поскольку белок действует не напрямую, а опосредованно, через нарушение механизма отрицательного контроля. Кроме выключения фактора V в организме присутствуют и другие пути остановки процесса коагуляции. Поэтому мутация Лейдена лишь ухудшает дезактивацию системы свертывания, а не полностью уничтожает ее.
Кроме того, патология проявляется лишь в случае, когда образование тромба уже инициировано какими-либо причинами. До запуска коагуляционного каскада присутствие мутантного белка не вызывает в организме никаких изменений.
Патогенез и симптомы
В большинстве случаев мутация Лейдена не имеет никаких симптоматических проявлений. Носитель может спокойно жить, даже не подозревая о ее существовании. Но иногда наличие мутации приводит к периодическому образованию тромбов. В таком случае симптоматика будет зависеть от места локализации кровяных сгустков.
Риск развития тромбоза зависит от количества мутировавших генов F5. Наличие одной копии повышает вероятность образования аномальных сгустков в 8 раз по сравнению с обладателем нормального генотипа в данном локусе. В таком случае мутация Лейдена считается гетерозиготной. При наличии в генотипе гомозиготы (двух копий мутировавшего гена) риск тромбофилии увеличивается до 80 раз.
Чаще всего симптоматическое проявление мутации Лейдена провоцируют другие факторы тромбоза, включая:
- уменьшение циркуляции кровотока;
- серьезные патологии сердечно-сосудистой системы;
- малоподвижный образ жизни;
- прием заместителей гормональной терапии (ЗГТ);
- операции;
- беременность.
Образование аномальных сгустков встречается у 10 % носителей мутации. Наиболее часто патология проявляется в ТГВ (тромбозе глубоких вен).
Тромбоз глубоких вен
Чаще всего тромбоз глубоких вен локализуется в нижних конечностях, но может развиваться также в мозге, глазах, почках и печени. Возникновение кровяных сгустков в ногах может сопровождаться:
- припухлостью;
- болью;
- повышением температуры;
- покраснением.
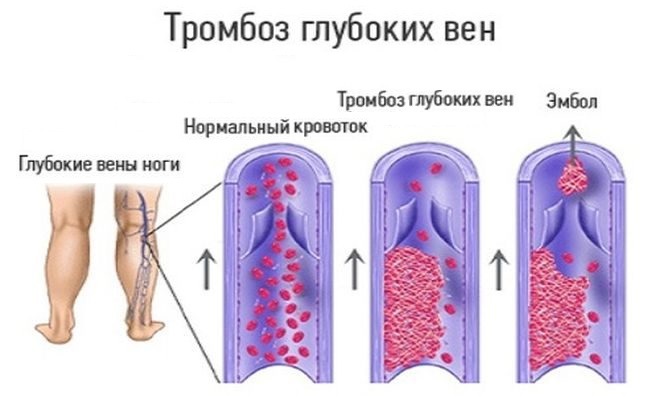
Иногда ТГВ не имеет симптоматических проявлений.
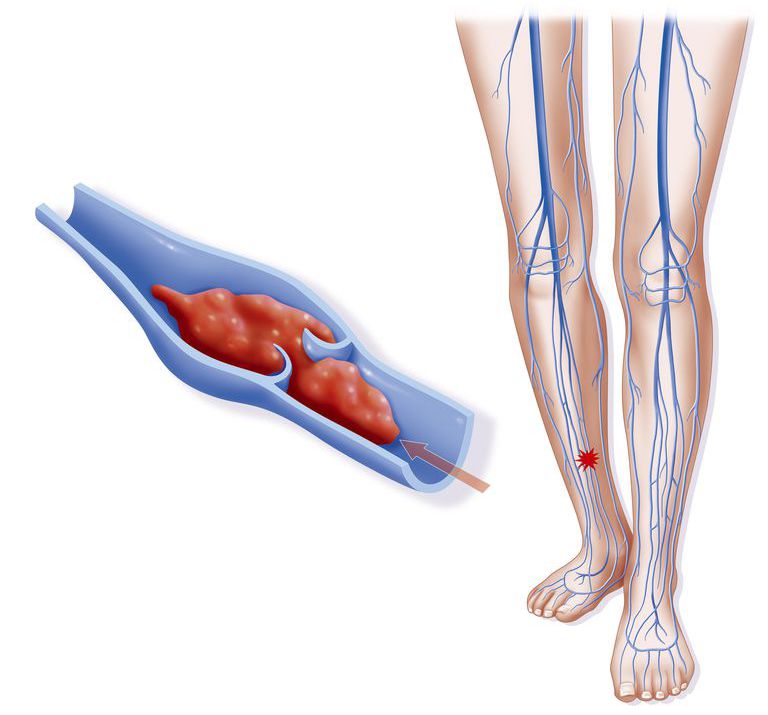
Тромбоз поверхностных вен
Тромбоз поверхностных вен при мутации Лейдена встречается гораздо реже, чем глубоких. Обычно он сопровождается покраснением, повышением температуры и болезненностью в области образования сгустка.
Образование сгустков в легких
Образование тромба в легких (иначе легочная эмболия) — одно из опасных проявлений мутации Лейдена, сопровождающееся такими симптомами, как:
- внезапная одышка;
- боль в грудной клетке при вдохе;
- выделение кровяной мокроты при кашле;
- тахикардия.
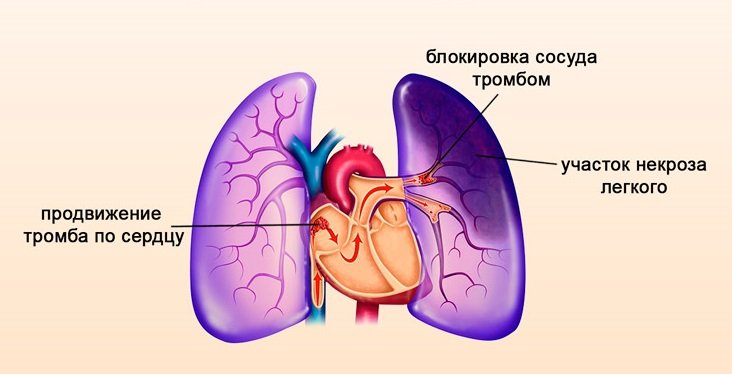
Данная патология является осложнением ТГВ и возникает, когда тромб отрывается от венозной стенки и через правый отдел сердца попадает в легкие, блокируя кровоток.
Опасность мутации при беременности
При беременности мутация Лейдена сопровождается небольшим риском появления выкидыша или преждевременных родов. Частота таких явлений у женщин с полиморфизмом гена F5 в 2-3 раза выше. Беременность также повышает риск развития тромбоза у носителей мутации.
Некоторые исследования показывают, что наличие фактора Лейдена увеличивает вероятность развития следующего ряда осложнений:
- преэклампсия (высокое кровяное давление);
- замедленный рост плода;
- преждевременное отделение плаценты от стенки матки.
Несмотря на эти риски, у большинства имеющих данную мутацию женщин беременность протекает нормально. Фактор Лейдена даже дает определенное преимущество, уменьшая вероятность развития обширного послеродового кровотечения. Тем не менее всем женщинам с мутацией Лейдена в период беременности рекомендован строгий медицинский контроль.
Лечение заболевания
Лечение мутации Лейдена осуществляется только при наличии тромбофилии и носит симптоматический характер. Исключить причину заболевания невозможно, поскольку медицина не обладает методами, позволяющими изменять геном.
Патологические проявления мутации Лейдена устраняются путем приема антикоагулянтов. В случае периодически повторяющегося тромбоза эти препараты назначаются на регулярной основе.


























