Аммиак - важное химическое вещество, широко используемое в промышленности и сельском хозяйстве. Рассмотрим строение его молекулы и механизм образования химических связей.
Строение молекулы аммиака
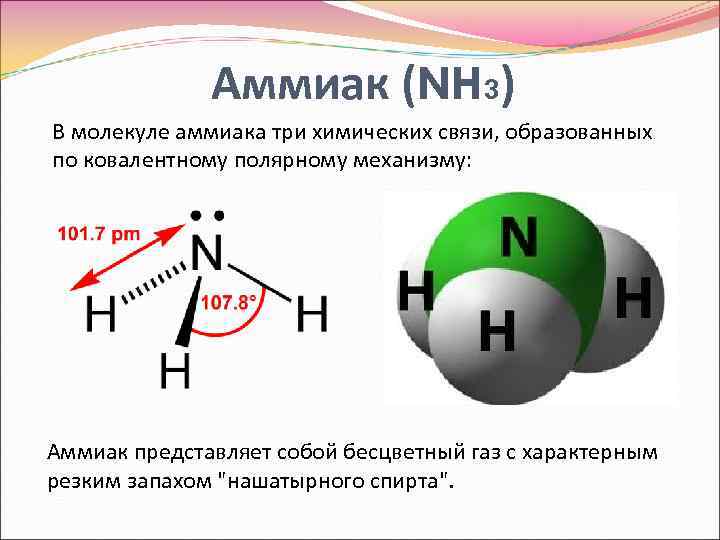
Молекула аммиака состоит из одного атома азота и трех атомов водорода. Ее формула в химии записывается как NH3. Атомы соединены ковалентными связями, образующими тетраэдрическую конфигурацию. Угол между связями составляет примерно 109,5°.
Образование химических связей в молекуле аммиака происходит следующим образом. Атом азота находится в ср3-гибридном состоянии. Это значит, что его одна s-орбиталь и три р-орбитали перекрываются и образуют четыре эквивалентные гибридные орбитали. Три из этих гибридных орбиталей взаимодействуют с орбиталями трех атомов водорода, образуя три ковалентные связи N-H.
Четвертая же гибридная орбиталь азота остается незадействованной и содержит один неспаренный электрон. Именно наличие этого неспаренного электрона придает молекуле аммиака основные свойства.
Химические свойства
Благодаря неспаренному электрону аммиак проявляет следующие химические свойства:
1. Взаимодействует с кислотами с образованием солей аммония:
NH3 + HCl → NH4Cl
2. Вступает в реакции замещения с галогенами, образуя аминогалогениды:
NH3 + Cl2 → NH2Cl + HCl
3. Окисляется кислородом до закиси азота:
4NH3 + 3O2 → 2N2O + 6H2O
Помимо этого аммиак способен восстанавливать оксиды металлов, давая амиды или нитриды. Он также активно взаимодействует с органическими соединениями, например альдегидами и кетонами.
Значение аммиака
Благодаря своей химической активности, аммиак нашел широкое применение в различных областях.
В промышленности из него получают азотную кислоту, нитраты, взрывчатые вещества, полимеры. Кроме того, аммиак используют для производства удобрений, в частности аммиачной селитры.
В сельском хозяйстве аммиачные удобрения позволяют существенно повысить урожайность многих культур. А благодаря способности восстанавливать оксиды металлов, аммиак применяют в гидрометаллургии для извлечения цветных и благородных металлов из руд.
Немаловажную роль аммиак играет и в биохимических процессах живых организмов. Он является одним из основных продуктов азотистого обмена, а также используется для поддержания кислотно-щелочного баланса.
Таким образом, необычная и интересная структура молекулы аммиака определяет его полезные химические свойства, благодаря которым это вещество нашло широкое применение в науке и технике.

Применение в химической промышленности
Одно из важнейших применений аммиака в промышленности - производство азотных удобрений. В частности, при взаимодействии аммиака с азотной кислотой получают нитрат аммония - основу аммиачной селитры:
NH3 + HNO 3 → NH4NO 3
Аммиачную селитру используют как основное азотное удобрение для многих сельскохозяйственных культур. Она легко усваивается растениями, стимулируя их рост и развитие.
Применение в органическом синтезе
Аммиак является важным реагентом в органическом синтезе. В частности, его используют в реакциях аминирования - для введения аминогруппы в молекулу органического вещества:
R-X + 2NH3 → R-NH2 + NH4X
Так можно получать разнообразные амины - производные аммиака, которые широко используются в фармацевтической, текстильной и других отраслях промышленности.
Биологическая роль аммиака
В живых организмах аммиак является одним из основных продуктов азотистого обмена. Он образуется в процессе дезаминирования аминокислот под действием ферментов.
Однако избыток аммиака токсичен для клеток. Поэтому в организме работает система детоксикации на основе орнитинового цикла, которая превращает аммиак в менее токсичную мочевину.
Нарушение этого механизма, например при заболеваниях печени, приводит к накоплению аммиака в крови и развитию гипераммониемии - опасного токсического эффекта.
Применение в холодильной технике
Благодаря низкой температуре кипения (-33,3 °C) аммиак используют в качестве хладагента в холодильных установках и кондиционерах.
Преимущества аммиака перед другими хладагентами:
- Высокая холодопроизводительность;
- Экологическая безопасность;
- Низкая стоимость.
Главный недостаток - токсичность. Поэтому аммиачные холодильные системы требуют особых мер безопасности и герметизации.
Перспективы использования аммиака
В последнее время аммиак рассматривают как перспективное топливо и накопитель энергии.
По сравнению с водородом, хранение и транспортировка аммиака проще и дешевле. А при сжигании выделяется только азот и вода, не загрязняя атмосферу.
Введение аммиака в энергетику позволит снизить использование ископаемых видов топлива и уменьшить выбросы парниковых газов.























