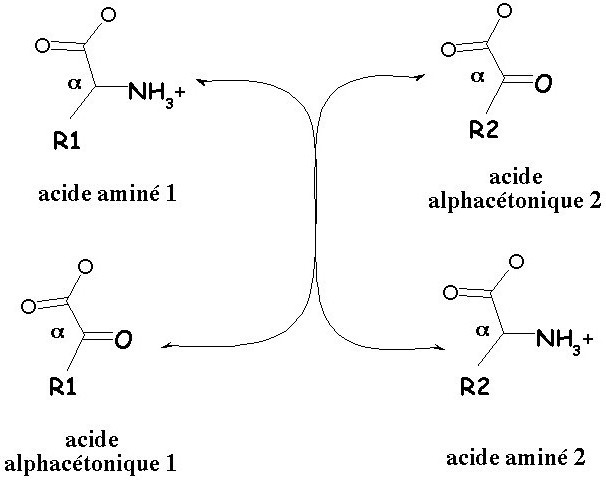
Трансаминирование аминокислот - это процессы межмолекулярного переноса от исходного вещества аминогруппы на кетокислоту без образования аммиака. Рассмотрим подробнее особенности данной реакции, а также ее биологический смысл.
История открытия
Реакция трансаминирования аминокислот была открыта советскими химиками Крицманом и Брайнштейном в 1927 году. Ученые работали над процессом дезаминирования глутаминовой кислоты в ткани мышц и выяснили, что по мере добавления к гомогенату мышечной ткани пировиноградной и глутаминовой кислот образуется аланин и α-кетоглутаровая кислота. Уникальность открытия была в том, что процесс не сопровождался образованием аммиака. В ходе экспериментов им удалось выяснить, что трансаминирование аминокислот - это обратимые процессы.
При протекании реакций в качестве катализаторов были использованы специфические ферменты, которые были названы аминоферазами (трансмаминазами).
Особенности процесса
Аминокислоты, участвующие в трансаминировании, могут быть монокарбоновыми соединениями. В ходе лабораторных исследований было установлено, что трансаминирование аспарагина и глутамина с кетокислотами происходит в тканях животных.
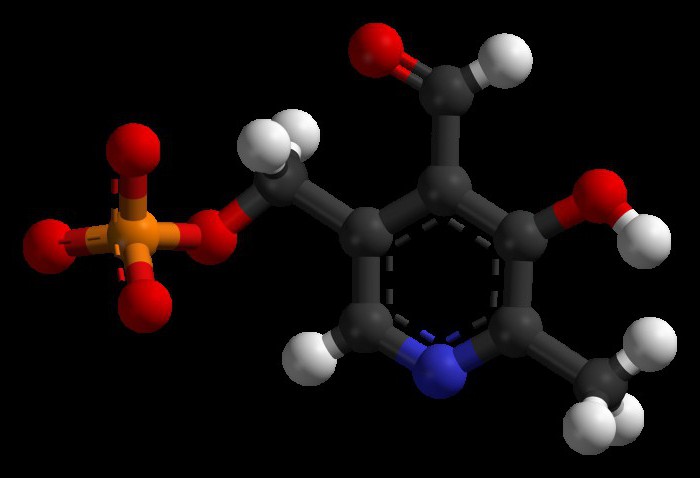
Активное участие в переносе аминогруппы принимает пиридоксальфосфат, являющийся коферментом трансаминаз. В процессе взаимодействия из него образуется пиридоксаминфосфат. В качестве катализатора подобного процесса выступают ферменты: оксидаза, пиридоксаминаза.
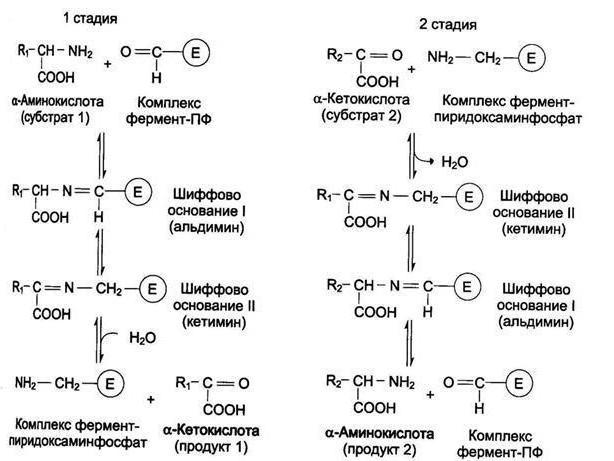
Механизм реакции
Трансаминирование аминокислот было объяснено советскими учеными Шемякиным и Браунштейном. У всех трансаминаз есть кофермент пиридоксальфосфат. Реакции трансминирования, которые он ускоряет, схожи по механизму. Процесс протекает в две стадии. Сначала пиридоксальфосфат забирает от аминокислоты функциональную группу, в результате образуется кетокислота и пиридоксаминфосфат. На второй стадии он вступает в реакцию с α-кетокислотой, в качестве конечных продуктов образуется пиридоксальфосфат, соответствующая кетокислота. В подобных взаимодействиях пиридоксальфосфат является переносчиком аминогруппы.
Трансаминирование аминокислот по такому механизму было подтверждено методами спектрального анализа. В настоящее время появились новые доказательства присутствия подобного механизма в живых существах.
Значение в обменных процессах
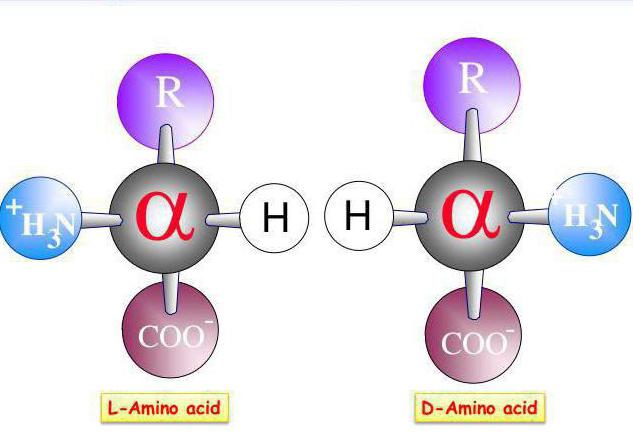
Какую роль играет трансаминирование аминокислот? Значение данного процесса достаточно велико. Эти реакции распространены у растений и микроорганизмов, в животных тканях благодаря высокой резистентности к химическим, физическим, биологическим факторам, абсолютной стереохимической специфичности по отношению к к D- и L-аминокислотам.
Биологический смысл трансаминирования аминокислот анализировался многими учеными. Он стал предметом подробного исследования в обменных аминокислотных процессах. В ходе исследований была выдвинута гипотеза о возможности протекания процесса трансаминирования аминокислот с помощью трансдезаминирования. Эйлер обнаружил, что в животных тканях из аминокислот с большой скоростью дезаминируется лишь L-глутаминовая кислота, катализатором процесса выступает глутаматдегидрогеназа.
Процессы дезаминирования и трансаминирования глутаминовой кислоты являются обратимыми реакциями.
Клиническое значение
Как используется трансаминирование аминокислот? Биологическое значение данного процесса состоит в возможности проведения клинических исследований. Например, сыворотка крови здорового человека имеет от 15 до 20 единиц трансаминаз. В случае органических поражений тканей наблюдается деструкция клеток, что приводит к выходу трансаминаз в кровь из очага поражения.
В случае инфаркта миокарда буквально через 3 часа уровень аспартатаминотрансферазы увеличивается до 500 единиц.
Как используется трансаминирование аминокислот? Биохимия предполагает проведение трансаминазного теста, по результатам которого больному ставят диагноз, подбирают эффективные методики лечения выявленного заболевания.
В диагностических целях в клинике болезней применяют специальные наборы химических веществ для быстрого выявления активности лактатдегидрогеназы, креатинкиназы, трансаминазы.
Гипертрансаминаземия наблюдается при болезнях почек, печени, поджелудочной железы, а также в случае острых отравлений четыреххлористым углеродом.
Трансаминирование и дезаминирование аминокислот используется в современной диагностике для выявления острых инфекций печени. Это связано с резким повышением аланинаминотрансферазы при некоторых проблемах с печенью.
Участники трансаминирования
Особую роль в данном процессе имеет глутаминовая кислота. Большое распространение в растительных и животных тканях, стереохимическая специфичность к аминокислотам, каталитическая активность сделали трансаминазы предметом изучения в научно-исследовательских лабораториях. Все природные аминокислоты (кроме метионина) взаимодействуют с α-кетоглутаровой кислотой в ходе трансаминирования, в итоге образуется кето- и глутаминовая кислота. Она подвергается под действием глутаматдегидрогеназы дезаминированию.
Варианты окислительного дезаминирования
Существует прямой и непрямой виды данного процесса. Прямое дезаминирование предполагает использование в качестве катализатора одного фермента, продуктом взаимодействия являются кетокислота и аммиак. Данный процесс может протекать аэробным способом, предполагающим присутствие кислорода, или анаэробным вариантом (без молекул кислорода).
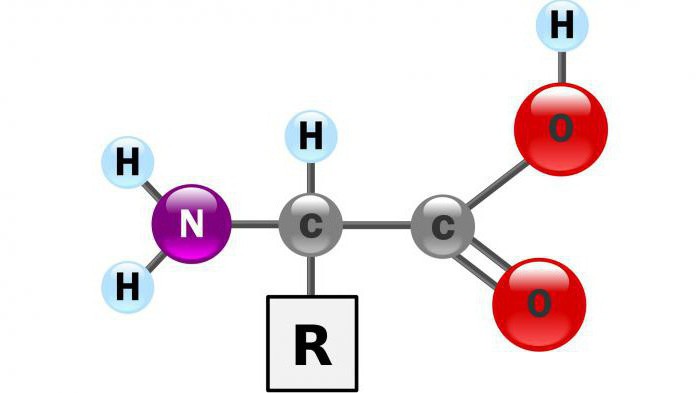
Особенности окислительного дезаминирования
В качестве катализаторов аэробного процесса выступают D-оксидазы аминокислот, а коферментами будут оксидазы L-аминокислот. Эти вещества присутствуют в человеческом организме, но они проявляют минимальную активность.
Анаэробный вариант окислительного дезаминирования возможен для глутаминовой кислоты, в качестве катализатора выступает глутаматдегидрогеназа. Этот фермент присутствует в митохондриях всех живых организмов.
При непрямом окислительном дезаминировании выделяют два этапа. Сначала аминогруппа переносится от исходной молекулы на кетосоединение, образуется новая кето- и аминокислоты. Далее кетоскелет специфическими путями катаболизирует, участвует в цикле трикарбоновых кислот и тканевом дыхании, конечными продуктами будут вода и углекислый газ. В случае голодания углеродный скелет глюкогенных аминокислот будет использоваться для образования в глюконеогенезе молекул глюкозы.
Второй этап предполагает отщепление аминогруппы путем дезаминирования. В человеческом организме подобный процесс возможен только для глутаминовой кислоты. В результате этого взаимодействия образуется α-кетоглутаровая кислота и аммиак.
Заключение
Определение активности двух ферментов трансаминирования аспартатаминтрансферазы и аланинаминотрансферазы нашло применение в медицине. Эти ферменты могут обратимо взаимодействовать с α-кетоглутаровой кислотой, переносить на нее от аминокислот функциональные аминогруппы, образуя кетосоединения и глутаминовую кислоту. Несмотря на то что активность этих ферментов увеличивается при болезнях сердечной мышцы и печени, максимальную активность обнаруживают в сыворотке крови для АСТ, а для АЛТ при гепатитах.
Аминокислоты незаменимы в процессах синтеза белковых молекул, а также образовании множества иных активных биологических соединений, способных регулировать в организме обменные процессы: гормонов, нейромедиаторов. Кроме того, они являются донорами атомов азота в синтезе небелковых азотсодержащих веществ, включая холин, креатин.
Кетаболизм аминокислот можно использовать как источник энергии для процесса синтеза аденозинтрифосфорной кислоты. Особую ценность энергетическая функция аминокислот имеет в процессе голодания, а также при сахарном диабете. Аминокислотный обмен позволяет устанавливать связи между многочисленными химическими превращениями, происходящими в живом организме.
В организме человека содержится около 35 грамм свободных аминокислот, а в крови их содержание составляет 3565 мг/дл. Большое их количество поступает в организм из пищи, кроме того, они есть в собственных тканях, также могут образовываться из углеводов.
Во многих клетках (кроме эритроцитов) они используются не только для белкового синтеза, но и для образования пуриновых, пиримидиновых нуклеотидов, получения биогенных аминов, фосфолипидов мембран.
За сутки в человеческом организме на аминокислоты распадается примерно 400 г белковых соединений, и примерно в таком же количестве происходит обратный процесс.
Тканевые белки не способны выполнять в случае катаболизма затраты аминокислот на синтез иных органических соединений.
В процессе эволюции человечество утратило способность к самостоятельному синтезу многих аминокислот, поэтому для обеспечения в полном объеме ими организма необходимо получать эти азотсодержащие соединения с пищей. Химические процессы, в которых участвуют аминокислоты, и сегодня являются объектом изучения химиков и медиков.


























