В природе не существует элементов, которые были бы чистыми. В основе своей все они представляют собой различные смеси. Они, в свою очередь, могут быть гетерогенными или гомогенными. Образовываются от веществ в агрегатном состоянии, создавая при этом определенную дисперсионную систему, в которой присутствуют различные фазы. Помимо этого, в смесях обычно присутствует дисперсионная среда. Ее сущность заключается в том, что она считается элементом с большим объемом, в котором распределено какое-либо вещество. В дисперсной системе фаза и среда расположены таким образом, чтобы между ними были частицы поверхности раздела. Поэтому она имеет название гетерогенной или неоднородной. Ввиду этого огромным значением обладает действие поверхности, а не частиц в целом.
Классификация дисперсной системы
Фазу, как известно, представляют вещества, имеющие различное состояние. А эти элементы подразделены на несколько видов. Агрегатное состояние дисперсной фазы зависит от сочетания в ней среды, в результате выходит 9 типов систем:
- Газ. Жидкость, твердое вещество и рассматриваемый элемент. Гомогенная смесь, туман, пыли, аэрозоли.
- Жидкая дисперсная фаза. Газ, твердое вещество, вода. Пены, эмульсии, золи.
- Твердая дисперсная фаза. Жидкость, газ и рассматриваемое в этом случае вещество. Почва, средства в медицине или косметике, горные породы.
Как правило, размеры дисперсной системы определяются по величине частиц фазы. Существует следующая классификация:
- грубые (взвеси);
- тонкие (растворы коллоидные и истинные).
Частицы дисперсионной системы
Разбирая грубые смеси, можно пронаблюдать, что частицы этих соединений в структуре могут быть заметны невооруженным глазом, ввиду того что их размер составляет более 100 нм. Взвеси, как правило, относятся к системе, в которой дисперсная фаза является разделимой от среды. Это происходит потому, что они считаются непрозрачными. Взвеси делятся на эмульсии (нерастворимые жидкости), аэрозоли (мелкие частицы и твердые вещества), суспензии (твердое вещество в воде).
Коллоидным веществом является любое, у которого есть качество того, чтобы другой элемент равномерно рассеивался по нему. То есть оно присутствует, а точнее входит в состав дисперсной фазы. Это состояние, когда один материал полностью распределяется в другом, а точнее в его объеме. В примере с молоком происходит рассеивание жидкого жира в водном растворе. В этом случае меньшая молекула находится в пределах 1 нанометра и 1 микрометра, что делает его невидимым для оптического микроскопа, когда смесь становится гомогенной.
То есть ни одна часть раствора не имеет большей или меньшей концентрации дисперсной фазы, чем любая другая. Можно сказать, что он является коллоидным по своей природе. Более крупный называется сплошной фазой или дисперсионной средой. Поскольку ее размер и распределение не изменяются, а рассматриваемый элемент распространяется по ней. Типы коллоидов включают аэрозоли, эмульсии, пены, дисперсии и смеси, называемые гидрозолями. Каждая подобная система имеет две фазы: дисперсную и непрерывную фазу.
Коллоиды по истории
Интенсивный интерес к таким веществам присутствовал во всех науках в начале 20-го века. Эйнштейн и другие ученые внимательно изучили их характеристики и приложения. В то время, эта новая область науки была ведущей областью исследований для теоретиков, исследователей и производителей. После пика интереса до 1950 года исследование коллоидов значительно уменьшилось. Интересно отметить, что с недавнего зарождения более высокомощных микроскопов и «нанотехнологий» (исследование объектов определенной крошечной шкалы) вновь возрастает научный интерес к исследованию новых материалов.
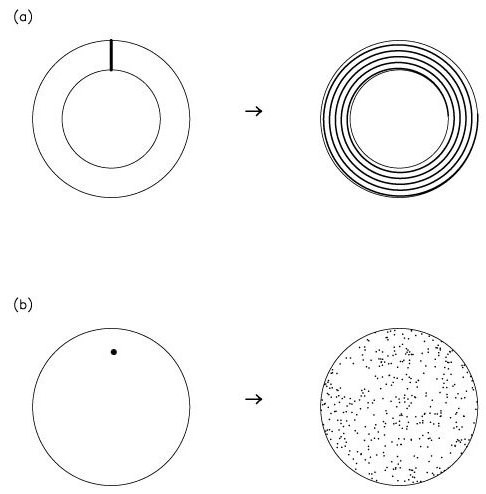
Подробнее об этих веществах
Существуют элементы, наблюдаемые как в природе, так и в искусственных растворах, обладающих коллоидными свойствами. Например, майонез, косметический лосьон и смазочные материалы являются типами искусственных эмульсий, а молоко представляет собой подобную смесь, которая встречается в природе. Коллоидные пены включают взбитые сливки и пену для бритья, в то время как съедобные элементы включают масло, зефир и желе. В дополнение к пище эти вещества существуют в виде некоторых сплавов, красок, чернил, детергентов, инсектицидов, аэрозолей, пенополистирола и резины. Даже красивые природные объекты, такие как облака, жемчуг и опалы, обладают коллоидными свойствами, потому что у них есть другое вещество, равномерно распределенное через них.
Получение коллоидных смесей
Увеличивая малые молекулы до диапазона от 1 до 1 микрометра, или путем уменьшения больших частиц до того же размера. Могут быть получены коллоидные вещества. Дальнейшее производство зависит от типа элементов, используемых в дисперсных и непрерывных фазах. Коллоиды ведут себя иначе, чем обычные жидкости. И это наблюдается в транспортных и физико-химических свойствах. Например, мембрана может позволить истинному раствору с твердыми молекулами, присоединенными к жидким, пройти через него. В то время как коллоидное вещество, которое имеет твердое тело, диспергированное через жидкость, будет растягиваться мембраной. Четность распределения является однородной до точки микроскопического равенства в промежутке по всему второму элементу.

Истинные растворы
Коллоидная дисперсия имеет представление в виде гомогенной смеси. Элемент состоит из двух систем: непрерывной и дисперсной фазы. Это указывает на то, что этот случай связан с истинными растворами, ибо они напрямую связаны с указанной выше смесью, состоящей из нескольких веществ. В коллоиде вторая имеет структуру мельчайших частиц или капель, которые равномерно распределены в первой. От 1 нм до 100 нм – это размер, составляющий дисперсную фазу, а точнее частиц, по меньшей мере в одном измерении. В таком диапазоне дисперсная фаза – это однородные смеси с указанными размерами можно назвать примерные элементы, подходящие под описание: коллоидные аэрозоли, эмульсии, пены, гидрозоли. Подвержены воздействию химического состава поверхности в значительной степени частицы или капли, присутствующие в рассматриваемых составах.
Коллоидные растворы и системы
Следует учитывать факт того, что размеры дисперсной фазы – это трудноизмеримая переменная в системе. Растворы иногда характеризуются собственными свойствами. Чтобы было легче воспринимать показатели составов, коллоиды их напоминают и выглядят почти так же. Например, если имеет диспергированную в жидкости, твердую форму. В результате через мембрану не будут проходить частицы. В то время когда иные компоненты вроде растворенных ионов или молекул способны пройти сквозь нее. Если анализировать проще, то получается, что растворенные компоненты проходят через мембрану, а с рассматриваемой фазой коллоидные частицы не смогут.

Появление и исчезновение цветовых характеристик
Из-за эффекта Тиндалля некоторые подобные вещества полупрозрачны. В структуре элемента он является рассеянием света. Другие системы и составы бывают с каким-то оттенком или вовсе быть непрозрачными, с определенным цветом, пусть некоторые даже с неярким. Многие знакомые вещества, в том числе масло, молоко, сливки, аэрозоли (туман, смог, дым), асфальт, краски, краски, клей и морская пена, являются коллоидами. Эта область исследования была введена в 1861 году шотландским ученым Томасом Грэмом. В некоторых случаях коллоид можно рассматривать как однородную (не гетерогенную) смесь. Это связано с тем, что различие между «растворенным» и «зернистым» веществом иногда может быть предметом подхода.
Гидроколлоидные типы веществ
Данный компонент определяется как коллоидная система, в которой частицы диспергируются в воде. Гидроколлоидные элементы в зависимости от количества жидкости могут принимать различные состояния, например, гель или золь. Бывают необратимыми (односоставными) или обратимыми. Например, агар, второй тип гидроколлоида. Может существовать в состоянии геля и золя, и чередуются между состояниями с добавлением или удалением тепла.
Многие гидроколлоиды получены из природных источников. Например, карраген экстрагируется из водорослей, желатин имеет бычий жир, а пектин из кожуры цитрусовых и яблочного жмыха. Гидроколлоиды используются в пищевых продуктах главным образом для воздействия на текстуру или вязкость (соус). Также применяются для ухода за кожей или как заживляющее средство после ранения.
Сущностные характеристики коллоидных систем
Из этой информации видно, что коллоидные системы – это подраздел дисперсной сферы. Они, в свою очередь, могут быть растворами (золями) или гелями (студни). Первые в большинстве случаев создаются на основе живой химии. Вторые формируются под осадками, которые возникают в процессе коагуляции золей. Растворы могут быть водными с органическими веществами, со слабыми или сильными электролитами. Размеры частиц дисперсной фазы коллоидов от 100 до 1 нм. Их невозможно увидеть невооруженным глазом. В результате отстаивания фазу и среду сложно разделить.

Классификация по типам частиц дисперсной фазы
Многомолекулярные коллоиды. Когда при растворении атомы или более мелкие молекулы веществ (имеющих диаметр менее 1 нм) объединяются вместе для образования частиц подобных размеров. В этих золях дисперсная фаза – это структура, которая состоит из агрегатов атомов или молекул с молекулярным размером менее 1 нм. Например, золото и сера. В этих коллоидах частицы удерживаются вместе силами Ван-дер-Ваальса. Они обычно имеют лиофильный характер. Это значит значительное взаимодействие частиц.
Высокомолекулярные коллоиды. Это вещества, имеющие молекулы большого размера (так называемые макромолекулы), которые при растворении образуют определенный диаметр. Такие вещества называются макромолекулярными коллоидами. Эти элементы, образующие диспергированную фазу, обычно представляют собой полимеры, имеющие очень высокие молекулярные массы. Естественные макромолекулы представляют собой крахмал, целлюлозу, белки, ферменты, желатин и т. д. Искусственные включают в себя синтетические полимеры, такие как нейлон, полиэтилен, пластмассы, полистирол и т. д. Они обычно лиофобны, что значит в этом случае слабое взаимодействие частиц.
Связанные коллоиды. Это вещества, которые при растворении в среде ведут себя как нормальные электролиты при низкой концентрации. Но представляют из себя коллоидные частицы с большей ферментной составляющей компонентов из-за образования агрегированных элементов. Образующиеся таким образом частицы заполнителей называются мицеллами. Их молекулы содержат как лиофильные, так и лиофобные группы.
Мицеллы. Представляют собой кластерные или агрегированные частицы, образованные ассоциацией коллоида в растворе. Обычными примерами являются мыла и моющие средства. Образование происходит выше определенной температуры Крафта, и выше определенной критической концентрации мицеллизации. Они способны образовывать ионы. Мицеллы могут содержать до 100 молекул и более, например, стеарат натрия является типичным примером. Когда он растворяется в воде, то дает ионы.




























