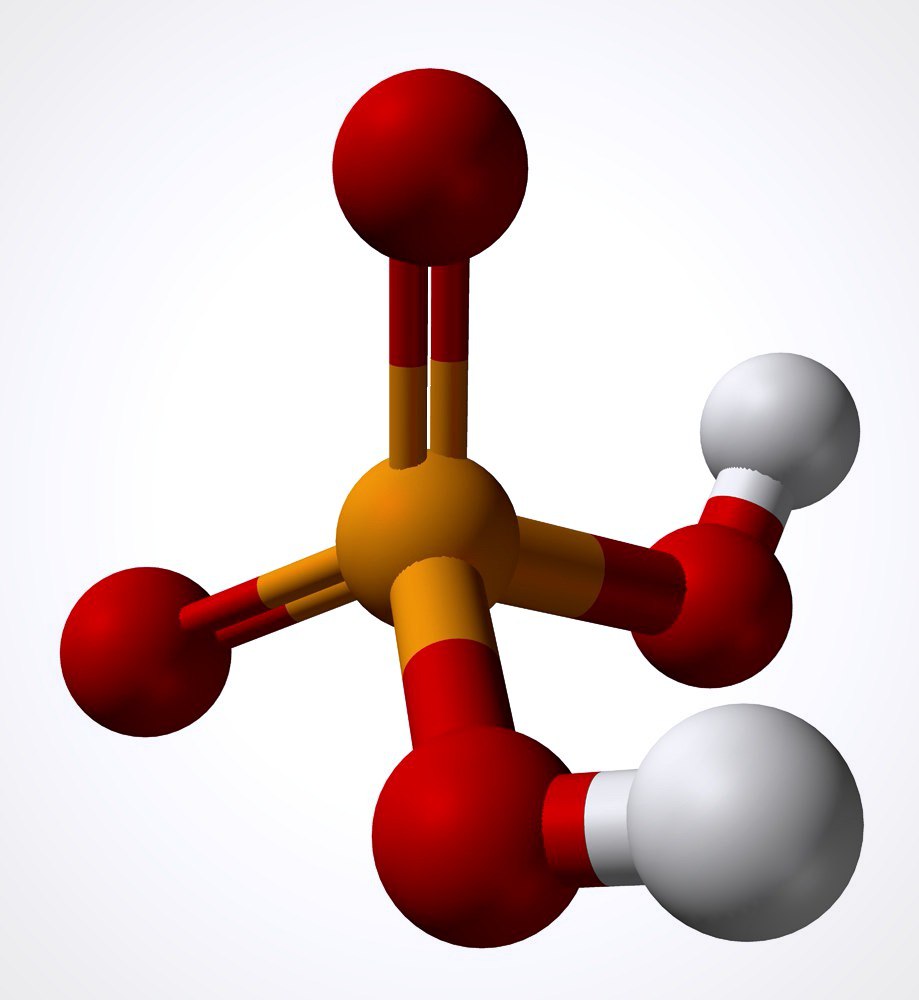
Селеновая кислота – это неорганическое вещество, состоящее из аниона селената и катиона водорода. Ее химическая формула – H2SeO4. Селеновая кислота, как и любое другое соединение, имеет уникальные свойства, благодаря которым она нашла широкое применение в определенных сферах. И об этом следует рассказать поподробнее.
Общие характеристики
Селеновая кислота относится к классу сильных. При стандартных условиях она выглядит как бесцветные кристаллы, которые отлично растворяются в воде. Данного вещества нужно опасаться, так как оно является ядовитым и гигроскопичным (поглощает из воздуха водяные пары). Также это соединение – мощный окислитель. Другие характеристики можно выделить в следующий перечень:
- Молярная масса равна 144,97354 г/моль.
- Плотность составляет 2,95 г/см³.
- Температура плавления достигает 58°C, а кипения - 260 °C.
- Показатель константы диссоциации равен -3.
- Растворимость в воде достигается при 30 °C.
Интересно, что селеновая кислота является одним из немногих веществ, способных растворить золото. К этому перечню еще относится цианид, раствор Люголя и царская водка. Но из кислот она такая единственная.

Получение вещества
Чаще всего синтезируют селеновую кислоту по формуле SeO3 + Н2О → H2SeO4. В ней отображено взаимодействие воды и оксида селена. Он представляет собой неорганическое вещество, легко растворяемое в уксусном ангидриде, серной кислоте, а также в диоксиде серы. Кстати, селеновое соединение может разложиться на оксид и воду под воздействием фосфорного ангидрида (Р2О5).
Кроме того, кислоту получают еще в результате реакций, когда главное вещество взаимодействует с хлорной или бромной водой. Вот по каким формулам селеновую кислоту получают в этих двух случаях:
- Se + 3Cl2 + 4Н2О → H2SeO4 + 6HCl.
- Se + Br2 + 4Н2О → H2SeO4 + 6HBr.
Но это не последние способы. Есть еще два. Получение селеновой кислоты из селена возможно вследствие его реакции с пероксидом водорода. Это выглядит так: SeO3 + Н2О2 → H2SeO4.

Применение
Теперь можно поговорить и о нем. Почему так важно получение селеновой кислоты? Потому что без нее невозможен синтез ее солей. Они больше известны как селенаты. О них будет рассказано чуть позже.
Применение селеновой кислоты в качестве окислителя встречается очень часто, поскольку она в данном процессе проявляет намного больше свойств, чем серная. Даже если ее разбавить. Если у серной кислоты электродные потенциалы равны примерно ~0,169 В, то у селеновой данный показатель достигает ~1,147 В. И разницу заметит каждый человек, даже не разбирающийся в химии.
Что и говорить, если селеновая кислота легко окисляет соляную, а еще растворяет золото, вследствие чего образуется селенат данного металла, представляющий собой красно-желтую жидкость.
Селенат аммония
Формула этой соли - (NH4)2SeO4. Данное вещество представлено бесцветными кристаллами. Они хорошо растворяются в воде, но не в ацетоне или этаноле. Проявляют общие свойства солей.
Их используют в качестве инсектицидов. Так называются вещества, используемые для уничтожения насекомых. Селенат аммония активно применяется при дезинсекции. Но использовать его нужно с особой осторожностью, так как данное вещество особо токсично. Но потому и эффективно.
Селенат бария
Его формула - BaSeO4. Эта соль, в отличие от предыдущей, в воде не растворяется. Но зато реагирует с серной кислотой, вследствие чего образуется селеновая и сульфат бария. Вот он и представляет особый интерес. Ведь сульфат бария – это рентгенопозитивное вещество, активно используемое в рентгенологии.
Данное соединение не токсично. Оно повышает контрастность получаемого в ходе рентгена изображения. Сульфат из пищеварительного тракта не всасывается, и в кровоток не попадает. Выводится со стулом, так что для человека безвредно. Применяется это вещество в виде суспензии внутрь, вместе с цитратом натрия и сорбитом.
Селенат бериллия
Эта соль с формулой BeSeO4 образует кристаллогидраты. Само вещество образуется очень интересно. Оно является итогом амфотерного гидроксида бериллия в селеновой кислоте. Диссоциация в результате дает образование бесцветных кристаллов, которые разлагаются при нагревании.
Где используются пресловутые гидроксиды? Обычно их применяют в качестве сырья, чтобы получить бериллий. Или используют в роли катализатора реакций полимеризации и Фриделя-Крафтса.

Селенат золота
У этого вещества формула такая - Au2(SeO4)3. Выглядит оно как мелкие кристаллы желтого цвета. Естественно, эта «соль» не растворяется в воде. На нее можно воздействовать только горячей концентрированной селеновой кислотой. Оксид селена вследствие этой реакции не образуется, но появится красновато-желтый раствор.
«Золотая» соль растворима также в азотной и серной кислотах. А вот хлороводород ее способен разрушить.
Получение селената золота происходит довольно быстро и просто. Для проведения реакции достаточно температуры в 230 °C.
Селенат меди
Формула данной соли выглядит так - CuSeO4. Это вещество представляет собой белые, растворимые в воде (но не в этаноле) кристаллы, которые тоже образуют кристаллогидраты.
Получают эту соль по следующей формуле: CuO + H2SeO4 → 40-50°C CuSeO4 + Н2О. Здесь отражено растворение оксида в селеновой кислоте, в результате которого еще и выделяется вода. Кстати, образующиеся кристаллогидраты впоследствии теряют часть Н2О. Для этого достаточно увеличить температуру до 110°C. А если она будет выше 350°C, то кристаллогидрат и вовсе начнет разлагаться.

Селенат натрия
Это последняя соль, в образовании которой задействована обсуждаемая кислота. Ее формула - Na2SeO4. Это соединение представляет собой определенный интерес, так как оно является результатом взаимодействия щелочного металла и сильной кислоты. Соль, кстати, растворима в воде, и тоже образует кристаллогидрат.
Получают ее разными способами. Наиболее распространенный подразумевает растворение в перекиси водорода селена. По формуле это выглядит так: Se + 2NaOH + 3Н2О2 → Na2SeO4 + 4Н2О.
Еще прибегают к окислению селенита натрия, выполняемое с помощью перекиси водорода, электролиза или же кислорода. Но самый простой метод подразумевает взаимодействие обсуждаемой кислоты с карбонатом натрия. Его иногда заменяют гидроокисью.
Это, пожалуй, самый активно используемый селенат. Он применяется, как лекарственное средство. В соответствии с АТХ, селенат натрия относится к минеральным добавкам. Однако ни в США, ни в России, ни один медикамент с его содержанием не зарегистрирован. А вот в Латвии и Дании такие препараты есть. Тот же «Bio-Selenium+Zinc», например. Прекрасное средство для укрепления иммунной системы.
Но вот в состав биологических добавок, продаваемых на территории России, селенат входит. Тот же «Супрадин Кидс Юниор» его содержит в количестве 12,5 мкг на одну таблетку.
В общем, именно посредством применения данного вещества врачи рекомендуют лечить дефицит селена в организме. Но, разумеется, перед применением необходимо пройти медицинское обследование и консультацию.
Как можно видеть, пусть селеновая кислота в чистом виде и не применяется, но вот значимость ее производных в химии, медицине и промышленности очевидна.



























