Отличные проводники электрического тока — золото, медь, железо, алюминий, сплавы. Наряду с ними существует большая группа веществ-неметаллов, расплавы и водные растворы которых тоже обладают свойством проводимости. Это сильные основания, кислоты, некоторые соли, получившие общее название "электролиты". Что такое ионная проводимость? Выясним, какое отношение имеют вещества-электролиты к этому распространенному явлению.

Какие частицы переносят заряды?
Мир вокруг полон различных проводников, а также изоляторов. Об этих свойствах тел и веществ известно с глубокой древности. Греческий математик Фалес провел опыт с янтарем (на греческом — «электрон»). Потерев его о шелк, ученый наблюдал явление притяжения волос, волокон шерсти. Позже стало известно, что янтарь является изолятором. В этом веществе нет частиц, которые могли бы переносить электрический заряд. Хорошие проводники — металлы. В их составе присутствуют атомы, положительные ионы и свободные, бесконечно малые отрицательные частицы — электроны. Именно они обеспечивают перенос зарядов, когда пропускают ток. Сильные электролиты в сухом виде не содержат свободных частиц. Но при растворении и расплавлении происходит разрушение кристаллической решетки, а также поляризация ковалентной связи.
Вода, неэлектролиты и электролиты. Что такое растворение?
Отдавая или присоединяя электроны, атомы металлических и неметаллических элементов превращаются в ионы. Между ними в кристаллической решетке существует достаточно прочная связь. Растворение или расплавление ионных соединений, например, хлорида натрия, приводит к ее разрушению. В полярных молекулах нет ни связанных, ни свободных ионов, они возникают при взаимодействии с водой. В 30-х годах XIX века М. Фарадей обнаружил, что растворы некоторых веществ проводят ток. Ученый ввел в науку такие важнейшие понятия:
- ионы (заряженные частицы);
- электролиты (проводники второго рода);
- катод;
- анод.
Есть соединения – сильные электролиты, кристаллические решетки которых полностью разрушаются с освобождением ионов.
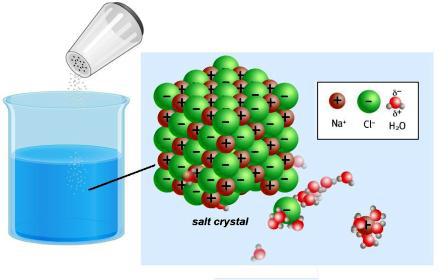
Существуют нерастворимые вещества и те, что сохраняются в молекулярном виде, например, сахар, формальдегид. Такие соединения называются неэлектролитами. Для них не характерно образование заряженных частиц. Слабые электролиты (угольная и уксусная кислота, гидроксид аммония и ряд других веществ) содержат мало ионов.
Теория электролитической диссоциации
В своих работах шведский ученый С. Аррениус (1859–1927) опирался на выводы Фарадея. В дальнейшем уточнили положения его теории русские исследователи И. Каблуков и В. Кистяковский. Они выяснили, что при растворении и расплавлении образуют ионы не все вещества, а только электролиты. Что такое диссоциация по С. Аррениусу? Это и есть разрушение молекул, которое приводит к появлению заряженных частиц в растворах и расплавах. Основные теоретические положения С. Аррениуса:
- Основания, кислоты и соли в растворах находятся в диссоциированном виде.
- Обратимо распадаются на ионы сильные электролиты.
- Слабые образуют мало ионов.

Показателем степени диссоциации вещества (ее часто выражают в процентах) является соотношение числа молекул, распавшихся на ионы, и общего количества частиц в растворе. Электролиты являются сильными, если значение этого показателя свыше 30%, у слабых — менее 3%.
Свойства электролитов
Теоретические выводы С. Аррениуса дополнили более поздние исследования физико-химических процессов в растворах и расплавах, проведенные русскими учеными. Получили объяснение свойства оснований и кислот. К первым относят соединения, в растворах которых из катионов можно обнаружить только ионы металла, анионами являются частицы OH–. Молекулы кислот распадаются на отрицательные ионы кислотного остатка и протоны водорода (H+). Движение ионов в растворе и расплаве — хаотичное. Рассмотрим результаты опыта, для которого потребуется собрать цепь, включить в нее угольные электроды и обыкновенную лампочку накаливания. Проверим проводимость растворов разных веществ: поваренной соли, уксусной кислоты и сахара (первые два – электролиты). Что такое электрическая цепь? Это источник тока и проводники, соединенные между собой. При замыкании цепи лампочка будет гореть ярче в растворе поваренной соли. Движение ионов приобретает упорядоченность. Анионы направляются к положительному электроду, а катионы — к отрицательному.
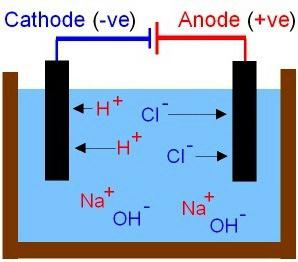
В этом процессе в уксусной кислоте участвует небольшое количество заряженных частиц. Сахар не является электролитом, не проводит ток. Между электродами в этом растворе окажется изолирующий слой, лампочка гореть не будет.
Химические взаимодействия между электролитами
При сливании растворов можно наблюдать, как ведут себя электролиты. Что такое ионные уравнения подобных реакций? Рассмотрим на примере химического взаимодействия между хлоридом бария и нитратом натрия:
2NaNO3 + BaCl2 + = 2NaCl + Ba(NO3)2.
Формулы электролитов запишем в ионном виде:
2Na+ + 2NO3– + Ba2+ + 2Cl– = 2Na+ + 2Cl– + Ba2+ + 2NO3–.
Взятые для реакции вещества - сильные электролиты. В этом случае состав ионов не меняется. Химическое взаимодействие между растворами электролитов возможно в трех случаях:
1. Если один из продуктов является нерастворимым веществом.
Молекулярное уравнение: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.
Запишем состав электролитов в виде ионов:
2Na+ + SO42– + Ba2+ + 2Cl– = BaSO4(белый осадок) + 2Na+ 2Cl–.
2. Одно из образовавшихся веществ — газ.
3. Среди продуктов реакции есть слабый электролит.
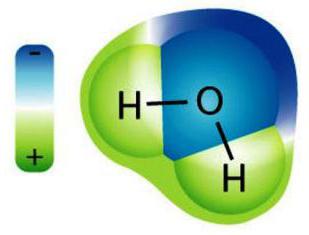
Вода — один из наиболее слабых электролитов
Химически чистая вода (дистиллированная) не проводит электрический ток. Но в ее составе есть небольшое количество заряженных частиц. Это протоны Н+ и анионы ОН–. Диссоциации подвергается ничтожно малое число молекул воды. Существует величина — ионное произведение воды, которая является постоянной при температуре 25 °C. Она позволяет узнать концентрации Н+ и ОН–. Преобладают ионы водорода в растворах кислот, гидроксид-анионов больше в щелочах. В нейтральных — совпадает количество Н+ и ОН–. Среду растворов также характеризует водородный показатель (рН). Чем он выше, тем больше присутствует гидроксид-ионов. Среда является нейтральной при интервале рН близком к 6–7. В присутствии ионов Н+ и ОН– изменяют свой цвет вещества-индикаторы: лакмус, фенолфталеин, метилоранж и другие.
Свойства растворов и расплавов электролитов находят широкое применение в промышленности, технике, сельском хозяйстве и медицине. Научное обоснование заложено в работах ряда выдающихся ученых, объяснивших поведение частиц, из которых состоят соли, кислоты и основания. В их растворах протекают многообразные реакции ионного обмена. Они используются во многих производственных процессах, в электрохимии, гальванике. Процессы в живых существах также происходят между ионами в растворах. Многие неметаллы и металлы, токсичные в виде атомов и молекул, незаменимы в виде заряженных частиц (натрий, калий, магний, хлор, фосфор и другие).


























