В таблице Менделеева неметаллы расположены в верхнем правом треугольнике, и при уменьшении номера группы их количество в ней также падает. В седьмой группе (галогены) все элементы - неметаллы. Это фтор, хлор, бром, йод и астат. Хотя последний мы не рассматриваем, так как он, во-первых, сам по себе радиоактивен, в земной коре встречается только в виде промежуточного продукта распада урана, а его соединение HAt (астатоводород), получаемое в лаборатории, крайне неустойчиво и в растворе ведет себя не так, как другие галогеноводороды. В шестой группе неметаллов уже поменьше (кислород, сера, селен и теллур, являющийся металлоидом), в пятой их три (азот, фосфор и мышьяк), в четвертой - два (углерод и кремний), а в третьей сидит одинокий бор. Водородные соединения неметаллов одной группы имеют схожие химические свойства.
Галогены
Галогеноводороды - это наиболее важные соединения галогенов. По своим свойствам это бескислородные кислоты, в воде диссоциирующие на анион галогена и катион водорода. Все они хорошо растворимы. Химическая связь между атомами в молекуле ковалентная, электронная пара смещена в сторону галогена как более электроотрицательного. Поскольку чем выше по таблице Менделеева, тем больше электроотрицательность атома, с уменьшением периода ковалентная связь становится все более и более полярной. Водород несет больший частичный положительный заряд, в растворе легче отрывается от галогена, то есть, соединение диссоциирует полнее и успешнее, и сила кислот возрастает в ряду от йода до хлора. Мы не сказали про фтор, потому что в его случае наблюдается совершенно противоположное: плавиковая (фтороводородная кислота) - слабая и очень плохо диссоциирует в растворах. Это объясняется таким явлением, как водородные связи: водород внедряется в электронную оболочку атома фтора "чужой" молекулы, и возникает межмолекулярная связь, не позволяющая соединению диссоциировать как положено.
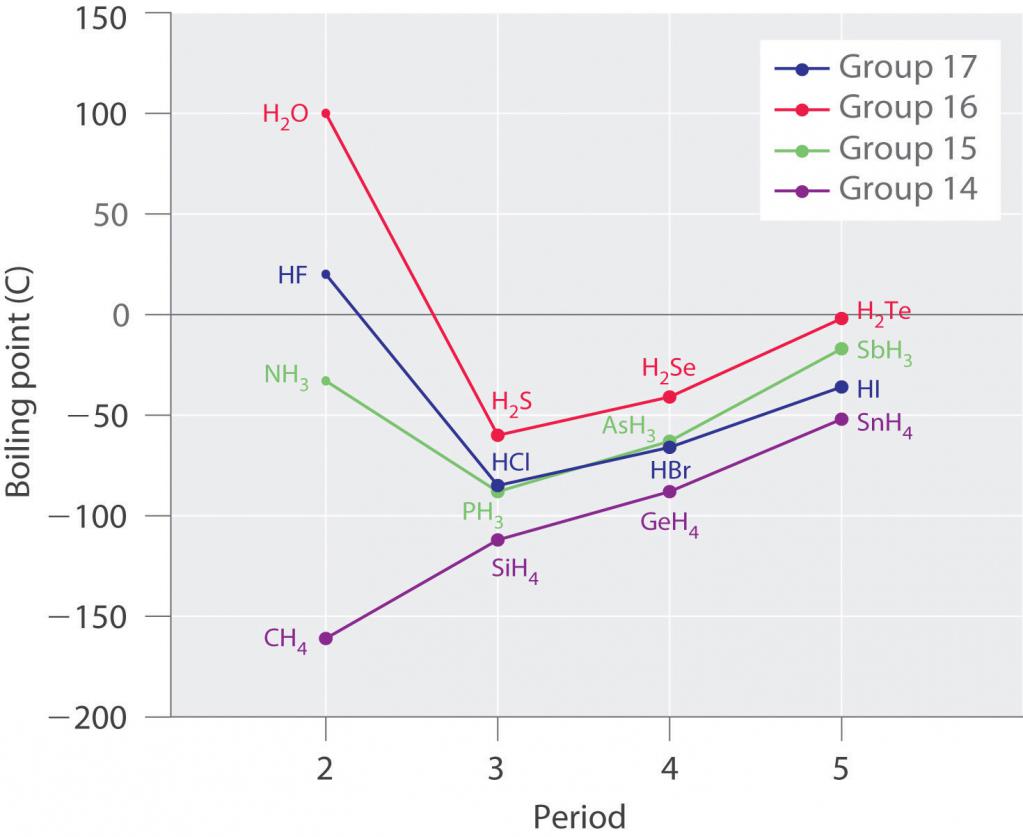
Это наглядно подтверждается графиком с температурами кипения различных водородных соединений неметаллов: из них выделяются соединения элементов первого периода - азота, кислорода и фтора - имеющих водородные связи.
Группа кислорода
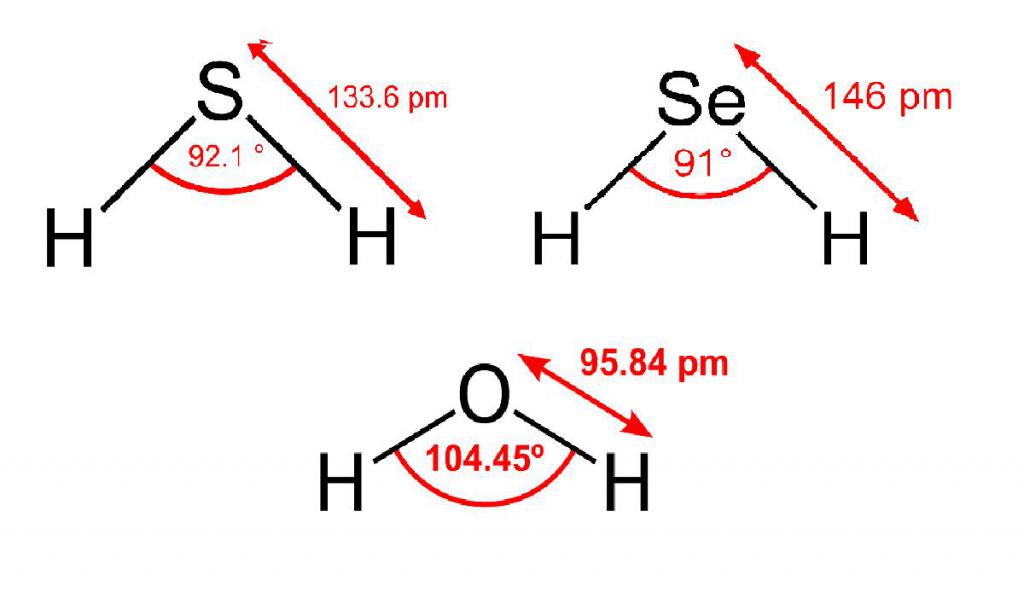
Водородное соединение кислорода - это, как очевидно, вода. Примечательного о ней сказать нечего, кроме того, что кислород в этом соединении, в отличие от серы, селена и теллура в аналогичных, находится в sp3-гибридизации - об этом говорит валентный угол между двумя связями с водородом. Предполагается, что у остальных элементов 6 группы такого не наблюдается из-за большой разницы в энергетических характеристиках внешних уровней (у водорода 1s, у кислорода - 2s, 2p, в то время как у остальных соответственно 3, 4 и 5).
Сероводород выделяется при гниении белка, поэтому проявляется запахом тухлых яиц, ядовит. В природе встречается в виде вулканического газа, выделяется живыми организмами при уже упомянутых процессах (гниение). В химии используется в качестве сильного восстановителя. При извержении вулканов, смешиваясь с сернистым газом, образует вулканическую серу.
Селеноводород и теллуроводород - тоже газы. Страшно ядовиты и обладают еще более отвратительным запахом, чем сероводород. По мере увеличения периода восстановительные свойства увеличиваются, сила водных растворов кислот - тоже.
Группа азота
Аммиак - одно из самых известных водородных соединений неметаллов. Азот здесь также находится в sp3-гибридизации, сохраняя при себе одну неподеленную электронную пару, за счет которой потом образует различные ионные соединения. Обладает достаточно сильными восстановительными свойствами. Известен хорошей способностью (за счет все той же неподеленной электронной пары) к образованию комплексов, выступая в роли лиганда. Известны аммиачные комплексы меди, цинка, железа, кобальта, никеля, серебра, золота и еще много чего.
Фосфин - водородное соединение фосфора - обладает еще более сильными восстановительными свойствами. Крайне ядовит, на воздухе самовоспламеняется. Имеет димер, присутствующий в смеси в малых количествах.
Арсин - мышьяковистый водород. Токсичен, как и все соединения мышьяка. Имеет характерный чесночный запах, появляющийся за счет окисления части вещества.
Углерод и кремний
Метан - водородное соединение углерода - начальная точка на необозримом пространстве органической химии. Так случилось именно с углеродом, потому что он умеет образовывать длинные устойчивые цепи со связями углерод-углерод. В рамках этой статьи стоит сказать, что атом углерода также имеет здесь sp3-гибридизацию. Основная реакция метана - это сжигание, в ходе которого выделяется большое количество тепла, из-за чего метан (природный газ) используют в качестве топлива.
Силан - аналогичное соединение кремния. Он самовоспламеняется на воздухе и сгорает. Примечательно то, что он также способен к образованию цепочек, похожих на углеродные: известны, например, дисилан и трисилан. Проблема в том, что кремний-кремниевая связь гораздо менее устойчива, и цепочки легко разрушаются.
Бор
С бором все очень интересно. Дело в том, что простейшее его водородное соединение - боран - нестабильно и димеризуется, образовывая диборан. Диборан самовоспламеняется на воздухе, но сам по себе стабилен, как и некоторые последующие бораны, содержащие в цепочке до 20 атомов бора - в этом они продвинулись дальше силанов с максимальным числом в 8 атомов. Все бораны ядовиты, в том числе обладают свойствами нервно-паралитических отравляющих веществ.
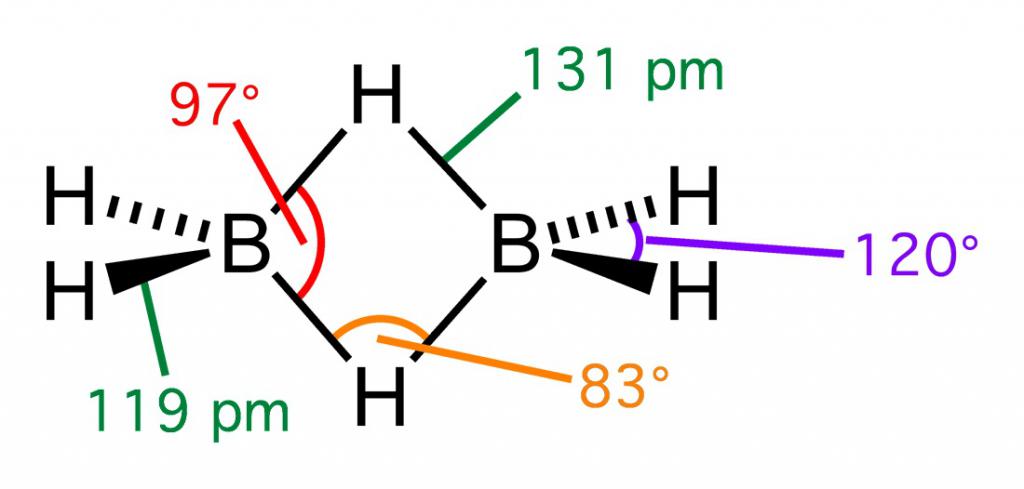
Молекулярные формулы водородных соединений неметаллов и металлов пишутся одинаково, однако в строении они различаются: у гидридов металлов ионное строение, у неметаллов - ковалентное.

























